a. グルタミン酸によるDARPP-32リン酸化調節
b. アセチルコリンによるDARPP-32リン酸化調節
c. アデノシンによるDARPP-32リン酸化調節
| (1) 線条体タンパク質DARPP-32のリン酸化とその機能 | |||||||||
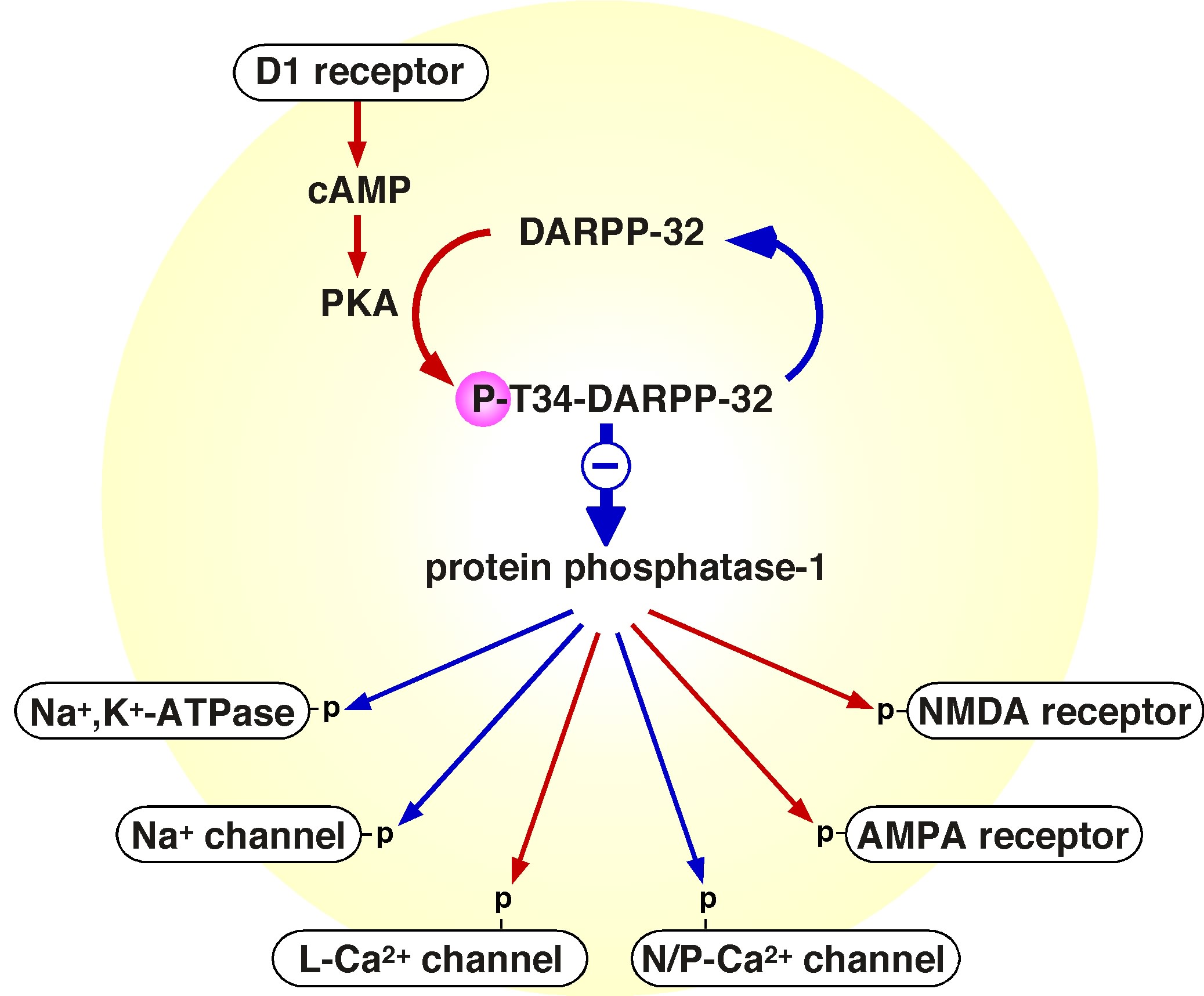
| 黒質ドーパミン作動性神経の投射部位である線条体には、PKAによりリン酸化されるタンパク質DARPP-32が選択的に発現している。DARPP-32はThr34残基がPKAによりリン酸化されるとプロテインホスファターゼ1(PP-1)活性を抑制するという特徴を持つ。PP-1により機能が調節される蛋白として、NMDA受容体、AMPA受容体、Na+チャンネル、Ca2+チャンネル、Na+,K+-ATPaseなどが知られている。 |
|||||||||
 |
|||||||||
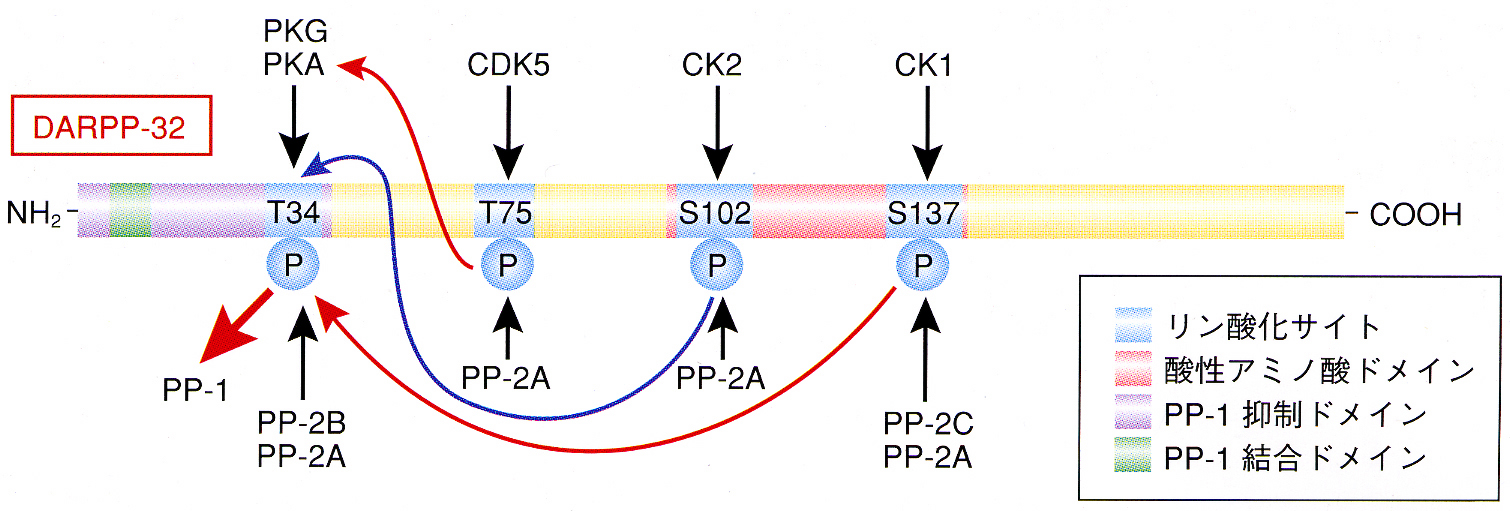
| DARPP-32はPKAの他に、Cdk5(Thr75残基)、CK2(Ser97残基)、CK1(Ser130残基)によりリン酸化される。Cdk5によってリン酸化されたDARPP-32は、PKA活性を抑制する。つまり、DARPP-32は、Thr34残基あるいはThr75残基のリン酸化により、PP-1抑制タンパクとしてもPKA抑制タンパクとしても機能する。 | |||||||||
 |
|||||||||
| Ser97残基、Ser130残基リン酸化は、DARPP-32分子内メカニズムによりThr34残基リン酸化・脱リン酸化のカイネティクスを調節している。CK2によるDARPP-32 Ser97残基リン酸化はThr34残基のPKAによるリン酸化を促進し、CK1によるSer130残基リン酸化はThr34残基のカルシニューリンによる脱リン酸化を抑制する。その結果、Ser97残基、Ser130残基リン酸化により、ドーパミンD1受容体/PKA/P-Thr34 DARPP-32/PP-1情報伝達は促進される。 | |||||||||
| (2) ドーパミンによるDARPP-32リン酸化調節 | |||||||||
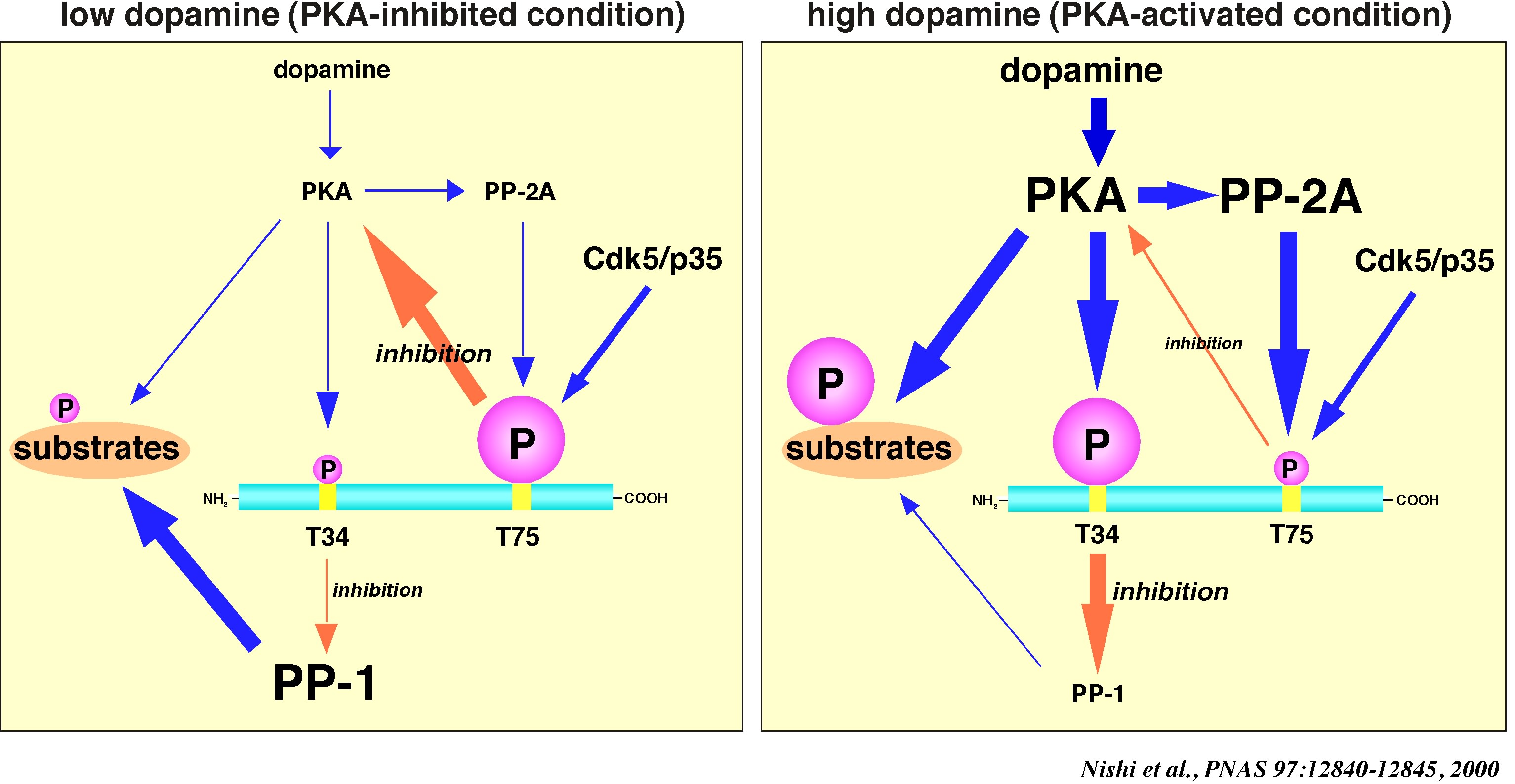
| ドーパミン受容体はD1タイプ(D1、D5)とD2タイプ(D2、D3、D4)に分類される。D1タイプ受容体はGs蛋白(線条体中型有棘神経ではGolfα)を介してアデニル酸シクラーゼ活性、cAMP産生、PKA活性を促進し、DARPP-32 Thr34残基リン酸化を促進する。一方、ドーパミンD2受容体はGi蛋白を介してアデニル酸シクラーゼ活性、cAMP産生、PKA活性を抑制すると同時に、細胞内Ca2+上昇によるカルシニューリン活性化によりThr34残基の脱リン酸化を促進する。つまり、DARPP-32 Thr34残基リン酸化の調節において、ドーパミンD2受容体はD1受容体に対して拮抗的に作用する。 | |||||||||
 |
|||||||||
| ドーパミンによるDARPP-32リン酸化調節機構を図に示す。ドーパミン放出量が少ない条件下(図左)では、PKA活性は低く、Thr34残基リン酸化は低く保たれているためにPP-1活性は高い。また、Thr75残基リン酸化DARPP-32によりPKA活性は抑制されている。その結果、AMPA受容体GluR1サブユニットなどのPKAでリン酸化されPP-1で脱リン酸化されるPKA/PP-1基質のリン酸化レベルは低く保たれている。ドーパミン放出が亢進すると(図右)、ドーパミンD1受容体を介してPKAが活性化される。PKAはPP-2Aを活性化しDARPP-32 Thr75残基の脱リン酸化を促進するため、Thr75残基リン酸化DARPP-32によるPKAの抑制が解除される。つまり、DARPP-32 Thr75残基はPKA活性調節のポジティブフィードバック機構として働いている。活性化されたPKAによりDARPP-32 Thr34残基リン酸化は亢進し、PP-1活性を抑制する。PKA/PP-1基質のリン酸化は高いPKA活性と低いPP-1活性により相乗的に促進される。このように、DARPP-32は、Thr34残基およびThr75残基リン酸化調節を介して、ドーパミン情報伝達の増幅分子機構として作用している。 | |||||||||
| (3) 神経伝達物質シグナルを統合するDARPP-32 | |||||||||
| DARPP-32はドーパミン作用増幅因子であるとともに、複数の神経伝達物質シグナルの統合分子としても重要である。線条体神経機能は、大脳皮質と視床からの興奮性グルタミン酸作動性入力と黒質や腹側被蓋野からのドーパミン作動性入力により調節を受けている。グルタミン酸はNMDA受容体、AMPA受容体、代謝型グルタミン酸受容体(mGluR)を介してドーパミン/DARPP-32情報伝達系と複雑な相互作用を示す。さらに、線条体神経機能は、アセチルコリンを神経伝達物質とする介在神経や、アデノシンにより調節を受けている。私たちは、マウス線条体スライスを用いて、グルタミン酸、アセチルコリン、アデノシンなどの神経伝達物質あるいは神経ペプチドにより活性化される情報伝達系を検討し、ドーパミン/DARPP-32情報伝達系との相互作用の解析を行っている。
a. グルタミン酸によるDARPP-32リン酸化調節 |
|||||||||