お知らせ
| 2024.09.14 | 今井さんが九州微生物研究フォーラム 2024において若手奨励賞を受賞しました。 |
| 2024.04.01 | Debora Satie Nagano(ポスドク)が着任しました。 |
| 2023.10.05 | 当講座がEQUAL (大学広報誌) 10月号の「ようこそ研究室へ」に取り上げられました。 リンク |
| 2023.10.03 | 今井有未さんが大学院医学研究科博士課程に入学しました。 |
| 2023.09.13 | 山本講師が第25回腸管出血性大腸菌感染症研究会において奨励賞を受賞しました。 |
| 2023.09.02 | 星子研究員が九州微生物研究フォーラム 2023において若手奨励賞を受賞しました。 |
| 2023.06.05 | 奥野助教の提案課題が石橋学術振興基金助成金に採択されました。 |
| 2023.02.28 | 山本講師の提案課題が科研費(基盤C)に採択されました。 |
| 2022.10.14 | 奥野助教が第24回腸管出血性大腸菌感染症研究会において奨励賞を受賞しました。 |
| 2022.04.20 | 小椋教授の提案課題がAMED・新興再興事業(海外拠点活用)に採択されました。 |
| 2022.04.01 | Nagano裕貴博士(ポスドク)が着任しました。 |
| 2022.02.28 | 奥野助教の提案課題が科研費(若手)に採択されました。 |
| 2021.04.01 | 小椋教授の提案課題がAMED・新興再興事業に採択されました。 |
| 2021.03.31 | 木田准教授が退職されました。 |
| 2020.12.01 | 奥野未来助教が着任しました。 |
| 2020.09.17 | ホームーページを開設しました。 |
| 2020.06.01 | 小椋義俊教授が着任されました。 |
沿革
本講座の前身である細菌学教室は1929年に開講し、初代 登倉登教授、第二代 占部薫教授、第三代 中川洋教授へと引き継がれました。1956年に微生物学教室への改名に伴い細菌学講座とウイルス学講座の二講座での構成となりました。その後、細菌学講座(2007年から現感染医学講座基礎感染医学部門に改称)は、中村昌弘教授、荒井澄夫教授、桑野剛一教授を経て、2020年6月より、小椋義俊が担当することとなりました。研究紹介
我々の研究室では、主に病原細菌を対象として、ゲノム科学、バイオインフォマティクス、分子生物学、細胞生物学などの手法を駆使して、その病原性の進化機構、生態学的意義、分子メカニズムの解明などを行っています。また、感染症の疫学調査や新規治療薬の開発などの臨床研究開発や、ゲノム情報解析を基盤とした様々な微生物や細菌叢に関する共同研究を実施しています。主な研究テーマ
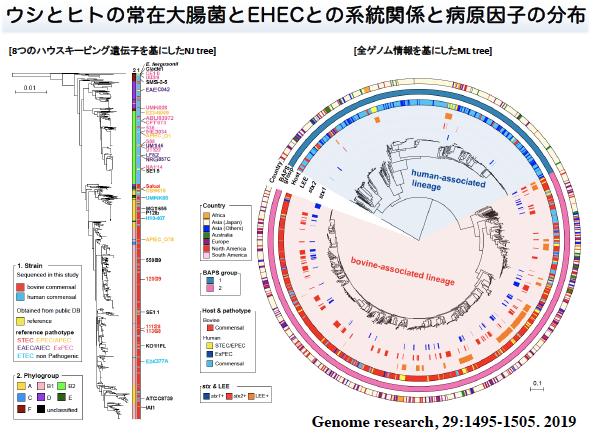
・病原性大腸菌出現機構の解明
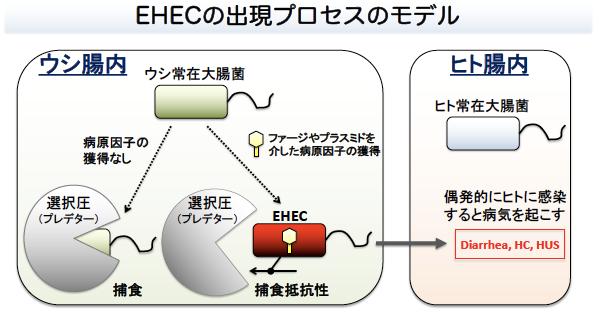
大腸菌は本来、ヒトを含めた脊椎動物に常在している非病原菌です。ほとんどの大腸菌株は無害ですが、一部の菌株はヒトに病原性を示し、病原性大腸菌と呼ばれます。O157を代表とする腸管出血性大腸菌(EHEC)は、出血性大腸炎や溶血性尿毒症症候群などの重篤な症状を引き起こすため、臨床的に特に重要です。主な宿主はウシと考えられており、ウシの便で汚染された食品などから感染します。我々は、ウシに常在している大腸菌に志賀毒素を含む様々な病原因子が蓄積することで、EHECが出現していることを明らかにしました。EHECは、ウシにはほとんど病気を起こしませんが、ウシ体内では、ウシ常在性大腸菌への病原因子の蓄積を促進する選択圧が存在し、蓄積した病原因子が協調して働くことが、大腸菌のウシ体内での生存に有利になっている可能性が示唆されました。現在、その選択圧の実態解明を目指して研究を進めており、その解明は、感染予防に繋がると期待されます。
大腸菌は本来、ヒトを含めた脊椎動物に常在している非病原菌です。ほとんどの大腸菌株は無害ですが、一部の菌株はヒトに病原性を示し、病原性大腸菌と呼ばれます。O157を代表とする腸管出血性大腸菌(EHEC)は、出血性大腸炎や溶血性尿毒症症候群などの重篤な症状を引き起こすため、臨床的に特に重要です。主な宿主はウシと考えられており、ウシの便で汚染された食品などから感染します。我々は、ウシに常在している大腸菌に志賀毒素を含む様々な病原因子が蓄積することで、EHECが出現していることを明らかにしました。EHECは、ウシにはほとんど病気を起こしませんが、ウシ体内では、ウシ常在性大腸菌への病原因子の蓄積を促進する選択圧が存在し、蓄積した病原因子が協調して働くことが、大腸菌のウシ体内での生存に有利になっている可能性が示唆されました。現在、その選択圧の実態解明を目指して研究を進めており、その解明は、感染予防に繋がると期待されます。
・プラスチック抗体を用いた細菌感染症治療薬の開発
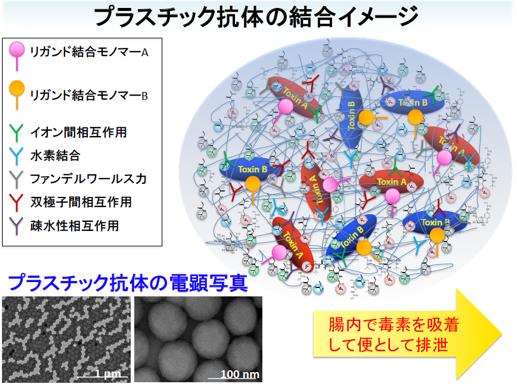
細菌感染症の中でも腸管出血性感染症やディフィシル菌感染症は、抗生物質による治療が難しいことが知られています。私達は、九州大学工学部の三浦教授、星野准教授らとの共同研究で、プラスチック抗体を用いた新規治療法の開発を進めています。プラスチック抗体技術では、抗原に親和性を示す種々の低分子を重合し、三次元構造をもたせた高分子ナノ粒子を作成することで、抗原を多点で認識でき、従来の高分子吸着剤に比べて高い親和性を有する物質を作成できます。安価で容易に作成できる上に、非常に安定で、不純物の混入がなく、腸から吸収されないサイズで作成することで、経口投与してもアレルギーなどの副作用の心配はほとんどなく、毒素を吸着・無毒化後、速やかに排泄されます。本技術は、モノクローナル抗体に変わる新しい技術として注目されており、細菌毒素に対するプラスチック抗体と抗生物質を併用することで効果的な治療が可能になると期待されます。
細菌感染症の中でも腸管出血性感染症やディフィシル菌感染症は、抗生物質による治療が難しいことが知られています。私達は、九州大学工学部の三浦教授、星野准教授らとの共同研究で、プラスチック抗体を用いた新規治療法の開発を進めています。プラスチック抗体技術では、抗原に親和性を示す種々の低分子を重合し、三次元構造をもたせた高分子ナノ粒子を作成することで、抗原を多点で認識でき、従来の高分子吸着剤に比べて高い親和性を有する物質を作成できます。安価で容易に作成できる上に、非常に安定で、不純物の混入がなく、腸から吸収されないサイズで作成することで、経口投与してもアレルギーなどの副作用の心配はほとんどなく、毒素を吸着・無毒化後、速やかに排泄されます。本技術は、モノクローナル抗体に変わる新しい技術として注目されており、細菌毒素に対するプラスチック抗体と抗生物質を併用することで効果的な治療が可能になると期待されます。
・原因不明下痢感染症の解析
集団下痢症事例では、検査したほぼすべての患者便から同一血清型の大腸菌が分離され、他の病原体も不検出でありながら、分離された大腸菌から、既知病原型の下痢原性大腸菌マーカー遺伝子が不検出となる事例が多数存在します。大腸菌は腸内の常在菌でもあるため、このような事例では、原因菌としての確定ができず、原因不明下痢症事例として処理されてしまい、感染源の特定などの原因究明が困難となります。このような大腸菌は、まだ知られていない全く新規の病原因子を保持する新型の下痢原性大腸菌である可能性が考えられます。我々は、このような大腸菌と健康なヒト由来の常在大腸菌とを大規模に比較することで、新規病原因子の同定と新型下痢原性大腸菌の発見を目指しています。本研究の成果は、今後の臨床検査や疫学調査などに大きく貢献できます。
・大腸菌近縁菌株の病原性ポテンシャルの解明
Escherichia属には、E. coli, E. albertii, E. fergusoniiの3種に加えて、遺伝的に異なる6つのCryptic Escherichia clade(以後clade I-VI)が存在します。clade I-VIのヒトや動物への病原性はいずれも不明です。我々は、ウシから大腸菌として分離した約1000株の菌株から、21株のclade Iを同定しましたが、そのすべてが志賀毒素2a型(Stx2a)陽性であることを見出しました。Stxは、腸管出血性大腸菌の主要な病原因子であり、出血性大腸炎やHUSなどの重篤な疾患の原因毒素です。clade I特異的遺伝子配列を用いて、データベース検索したところ、大腸菌としてゲノム配列が登録されている株の中に、複数のclade Iが含まれ、その中には臨床分離株も存在することが明らかになりました。これらの知見は、clade Iがヒトに対する病原性を有する可能性を示唆します。現在、clade Iの詳細なゲノム解析、疫学調査、環境中での分布などを調べています。
・家畜や水環境中における薬剤耐性菌の解析
薬剤耐性菌の蔓延が社会問題化していますが、その対策には医療現場だけでなく、家畜や環境中での薬剤耐性菌の分布調査が重要となります。我々は、家畜や環境から分離した細菌のゲノムを大規模に解析することで、環境中での耐性菌の伝播やその耐性獲得機構の解明を行っています。
・肺炎マイコプラズマによる免疫調節機構の解析
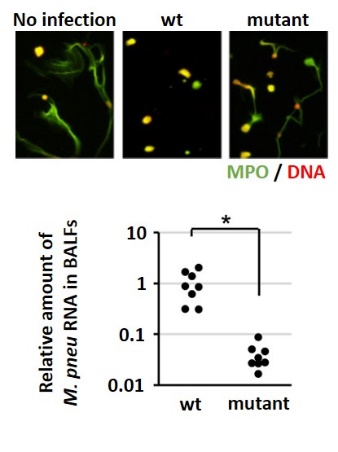
肺炎マイコプラズマは肺炎や気管支炎といった急性呼吸器疾患を引き起こす病原細菌で、呼吸器感染症の原因の第3位に位置する細菌です。肺炎マイコプラズマは臨床上非常に重要な細菌ではありますが、それ自体の細胞に対する傷害性は弱く、一般的な細菌とは異なる様式によって病原性を発揮すると考えられています。本教室では肺炎マイコプラズマに対する宿主の持続的かつ過剰な免疫応答が本菌感染症の発症の一因であるという考えのもと、①本菌の持続感染に関わる免疫調節機構の解析と②本菌に特徴的な免疫応答誘導機序の解析に取り組んでおり、これらの研究によってワクチンや治療薬の標的となる新たな分子の同定を目指しています。これまでに肺炎マイコプラズマが細胞外トラップと呼ばれる殺菌因子による殺菌作用を回避すること、また、感染の足場となる上皮細胞の細胞死を抑制することによって持続的に感染することを明らかにしています。
肺炎マイコプラズマは肺炎や気管支炎といった急性呼吸器疾患を引き起こす病原細菌で、呼吸器感染症の原因の第3位に位置する細菌です。肺炎マイコプラズマは臨床上非常に重要な細菌ではありますが、それ自体の細胞に対する傷害性は弱く、一般的な細菌とは異なる様式によって病原性を発揮すると考えられています。本教室では肺炎マイコプラズマに対する宿主の持続的かつ過剰な免疫応答が本菌感染症の発症の一因であるという考えのもと、①本菌の持続感染に関わる免疫調節機構の解析と②本菌に特徴的な免疫応答誘導機序の解析に取り組んでおり、これらの研究によってワクチンや治療薬の標的となる新たな分子の同定を目指しています。これまでに肺炎マイコプラズマが細胞外トラップと呼ばれる殺菌因子による殺菌作用を回避すること、また、感染の足場となる上皮細胞の細胞死を抑制することによって持続的に感染することを明らかにしています。
・その他の研究とゲノム研究支援活動
我々は、病原微生物、環境微生物、腸内細菌叢などを対象としたゲノム研究を共同研究として多数実施しています。



