近年、がん細胞とその周辺の間質細胞に存在する様々な細胞から構成されるがん微小環境が「がん」の増殖や転移、悪性化や薬剤耐性の原因の一つとなっていることがわかってきました。特に、炎症性腸疾患(IBD)や慢性閉塞性肺疾患(COPD)などの慢性炎症状態からの上皮異形成・癌化に至る過程でMAPキナーゼやWnt/ベータ-cateninシグナルの異常な活性化がみられます。これらのシグナル伝達系をいかに制御するかが今後の課題といえます。
最近の免疫チェックポイント阻害療法をはじめとした免疫療法の発展は目覚ましく、これまでの本学におけるがんワクチン研究もその一端を担ってきたといえます。この度、がんワクチン実用化に向けての開発レベルが大学から企業へと1段階進み、大学での役割を終えました。このため、がん研究の裾野をより広く網羅するという意味を含めて、当部門の名称を「がんワクチン分子部門」から「腫瘍免疫学部門」へと変更することになりました。
当部門では、今後とも、“Patient will answer you (治療が効くか効かないかは患者が答えを出してくれる)”という言葉を念頭におき、腫瘍免疫反応を調節することによる予防・診断・治療を含めた臨床応用を目指した基礎研究を展開していく所存です。
部門長 溝口 恵美子
- 主要ヒノキ花粉アレルゲンCha o 3に特異的なドミナントT細胞エピトープの同定
-
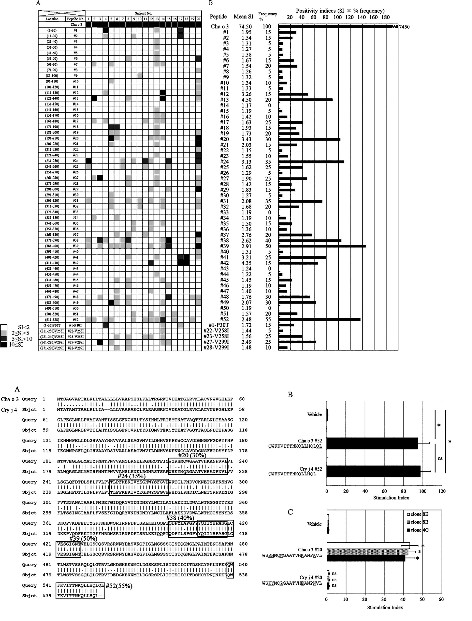
多くのヒノキ科・スギ科樹木由来の花粉が世界中で花粉症を引き起こしており、日本では、スギ(Cryptomeria japonica)やヒノキ(Chamaecyparis obtusa)の花粉が季節性アレルギー疾患の最大の原因となっています。近年、我々は新規の主要ヒノキ花粉アレルゲンCha o 3とその相同なスギ花粉アレルゲンCry j 4(どちらもセルラーゼに属する)を同定しました。両アレルゲンは高い相同性を有し(84%のアミノ酸配列が同一)、T細胞の交叉反応が見られました。しかし、同時に、Cry j 4の刺激に反応しないCha o 3特異的T細胞クローンも確立され、このことはCha o 3特有のエピトープが存在することを示唆しています。本研究では、20名のスギ・ヒノキ花粉症患者からCha o 3特異的T細胞株を確立し、5個のCha o 3特異的ドミナントT細胞エピトープを同定しました。このことは、日本のヒノキ花粉症に対するT細胞エピトープペプチドベを用いた新しいアレルゲン特異的免疫療法の開発を促進するものと期待され、更には、Cry j 4と共有しているが異なるCha o 3特異的なT細胞エピトープが存在する可能性も示しています。
本研究の成果はAllergol Int. 2020 Jan;69(1):141-143. doi: 10.1016/j.alit.2019.07.008. に公表されました。
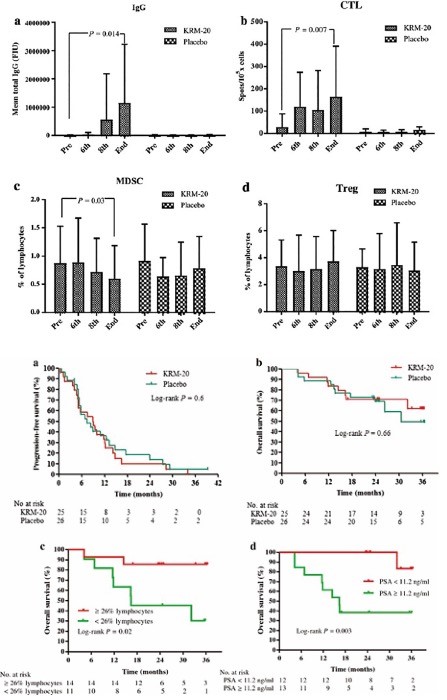
- 去勢抵抗性前立腺がん患者を対象とした20種混合ペプチドワクチンと化学療法併用療法の無作為化第2相臨床試験
-
12種類のがん関連抗原に由来する20種類の細胞傷害性T細胞(CTL)エピトープペプチドからなる新規がんペプチドカクテルワクチン(KRM-20)を開発し、去勢抵抗性前立腺がん患者(CRPC)において、化学療法(ドセタキセルとデキサメタゾン)と併用したときの抗腫瘍効果増強作用を検討しました。二重盲検プラセボ対象無作為化第二相臨床試験を実施し、10箇所の医療機関で登録された化学療法未実施のCRPC患者を無作為に1:1で化学療法併用KRM-20群(n=25)と化学療法のみのプラセボ群(n=26)に分けました。化学療法との併用においてKRM-20投与による毒性増強はありませんでした。2群間において前立腺特異抗原(PSA)が50%以上低下した症例割合に差はなく、無増悪生存期間や全生存期間にも差はありませんでした。投与ペプチド特異的免疫応答はワクチン併用群で有意に増加していました。サブグループ解析から、KRM-20はリンパ球数が26%以上もしくはPSAが11.2ng/mLより低い群において有効な治療約となることが示唆されました。
本研究の成果はCancer Immunol Immunother, 2020 Feb 5. doi: 10.1007/s00262-020-02498-8.に公表されました。
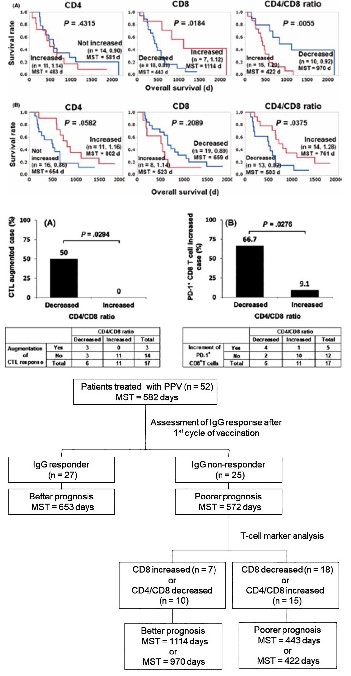
- CD4/CD8比はペプチドワクチン投与IgG非応答卵巣がん患者の予後因子である
-
免疫療法は全ての患者に効果が表れるわけではないので、がん免疫療法において有用なバイオマーカーを特定するのは急務です。我々は、テーラーメイドペプチドワクチン療法において早期のペプチド特異的IgG応答の誘導が良好な予後のバイオマーカーになりうることを報告してきましたが、長期生存者の中には、早期IgG応答を示さない症例もありました。本研究ではテーラーメイドペプチドワクチン療法を受けた進行期もしくは再発卵巣がん患者において古典的T細胞マーカー(末梢血中のCD8 カウントとCD4/CD8比)の有用性を検討しました。その結果、IgG非応答群(n=25)においてCD8増加群(n=7)もしくはCD4/CD8比減少群(n=10)の全生存期間が有意に長いことが示されました(p=0.018及びp=0.0055)。このことは、ペプチドワクチン投与IgG非応答卵巣がん患者においてCD8の増加及びCD4/CD8比の減少が良好な予後予測因子であることを示唆しています。
本研究の成果はCancer Sci. 2020 Apr;111(4):1124-1131. doi: 10.1111/cas.14349.に公表されました。
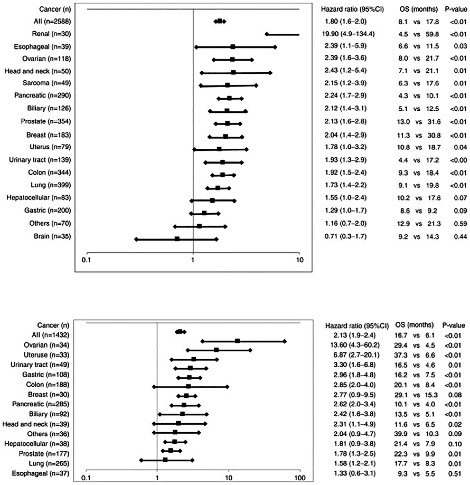
- テーラーメイドペプチドワクチンにおけるバイオマーカーの同定:2,588がん症例の解析
-
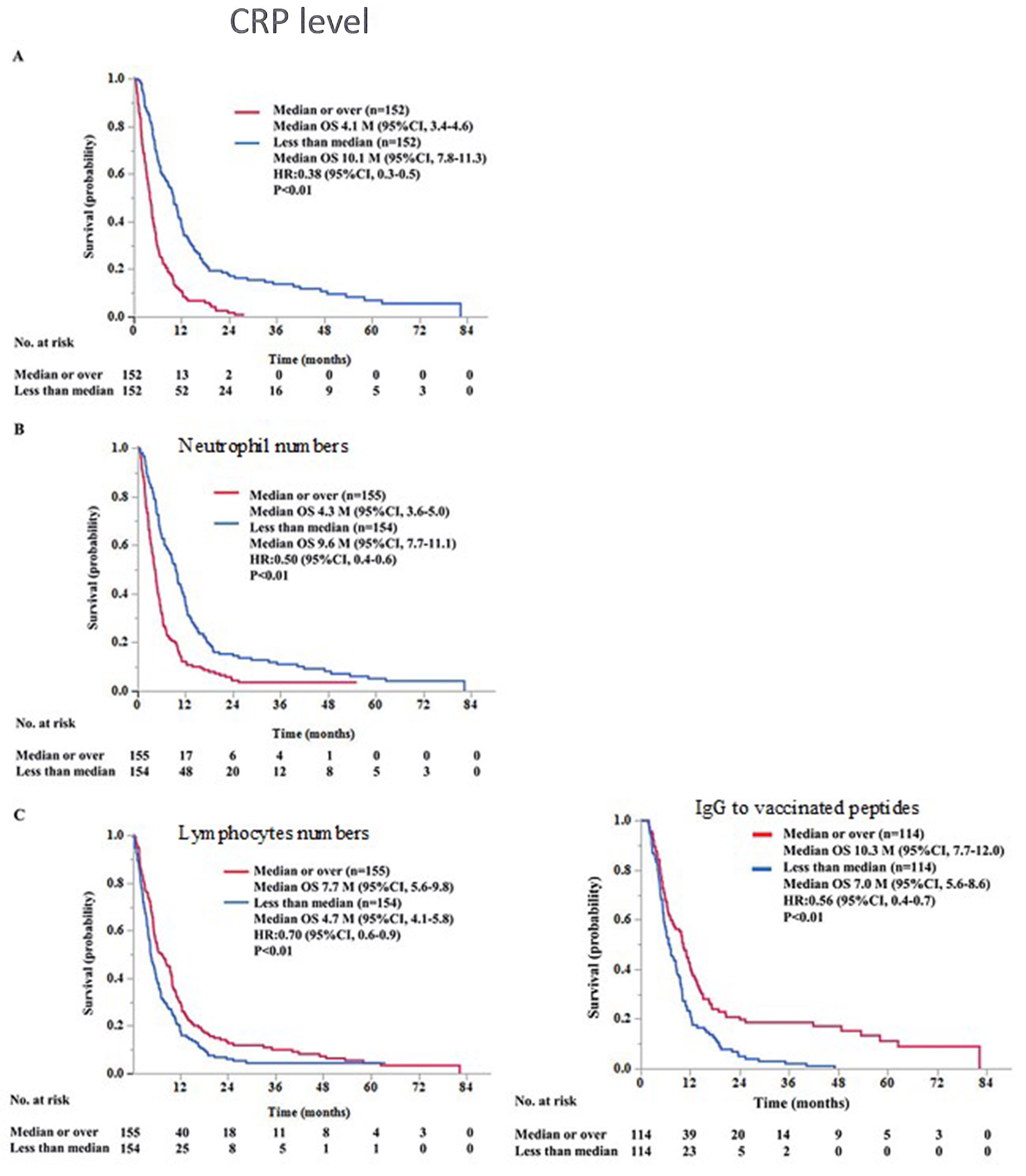
がんペプチドワクチンの臨床試験を1990年代より実施してきましたが、十分な臨床的効果を示すに至りませんでした。この結果を解明するために、テーラーメイドペプチドワクチン(PPV)療法を受けた2,588名の患者(肺がん399名、前立腺癌354名、大腸癌344名を含む)について、予後不良に関連するバイオマーカーの探索・解析を行いました。ワクチン投与前の高値の好中球数、単球数、血小板数、CRP及び他の可溶性炎症因子と、低値のリンパ球数、赤血球数が全生存期間(OS)と逆相関関係にあり、この中でも、64.8%以上の好中球数と25.1%以上のリンパ球数が最も有用な予後不良因子及び予後良好因子として示されました。投与ペプチド特異的抗体反応とOSに関連が見られましたが、投与前のペプチド特異的免疫レベルはOSに影響はありませんでした。以上より、投与前の炎症関連因子がPPV療法における低臨床効果に関連していることが示唆されました。
本研究の成果はInt J Oncol. 2020 Jun;56(6):1479-1489. doi: 10.3892/ijo.2020.5019.に公表されました。
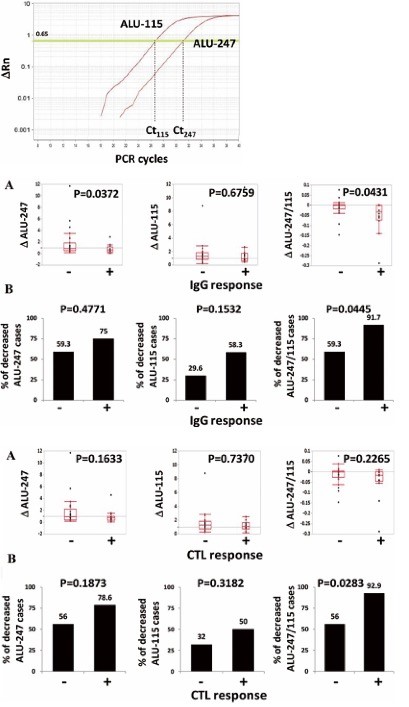
- 血漿中のDNA integrityとワクチンで誘導される抗腫瘍免疫とは逆相関する:卵巣がんでの解析
-
テーラーメイドペプチドワクチン療法第II相試験に登録された39名の進行もしくは再発卵巣がん患者の血漿を用いて、ワクチン投与前後の血漿DNA integrityと投与ペプチド特異的免疫応答との関連を解析しました。血漿DNA integrityはワクチン投与後に下がる傾向があり、血漿DNA integrityが減少した症例は、投与ペプチド特異的IgG応答群と非応答群ではそれぞれ91.7%と59.3%で逆相関関係が見られました(p=0.0445)。同様の傾向がCTL応答においても見られ、CTL応答群と非応答群において血漿DNA integrityの減少症例数は92.6%と56.0%でした(p=0.0283)。以上より、がんワクチン療法における血漿DNA integrityのバイオマーカーとしての有用性が示されました。
本研究の成果はCancer Immunol Immunother. 2020 May 11. doi: 10.1007/s00262-020-02599-4.に公表されました。
- 難治性トリプルネガティブ乳がん患者を対象とした19種混合ペプチドワクチン単剤療法の前期臨床第Ⅱ相試験
-
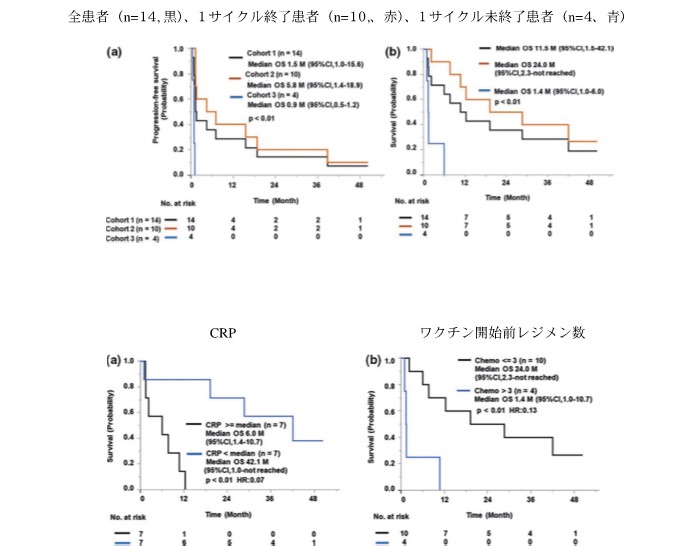
新しいタイプのがんワクチンを開発するため、全身化学療法耐性の転移性トリプルネガティブ乳がん患者14名を対象に19種混合ペプチドワクチン単剤療法の前期臨床第Ⅱ相試験を行いました。週1回のワクチンを6週(1サイクル)に渡り皮下投与しましたが、ワクチンによる重篤な副反応は見られませんでした。投与した19種のペプチドのうち患者自身とのHLAタイプが一致しているペプチドに対する特異的IgGの増加が認められ、このことは全生存期間(OS)と正の相関関係が見られました(P<0.01)。全14患者と1サイクルのワクチン終了した10患者のOSの中央値は11.5ヶ月と24.4カ月でした。C-反応性タンパク質が低値もしくはワクチン開始前に3レジメン以下の化学療法を受けていた患者群ではそうでない群に比べOSが長かったため、これらは低リスク因子であることが示唆されました。
本研究の成果はCancer Sci. 2020. Aug;111(8):2760-2769. doi:10.1111/cas.14510.に公表されました。(臨床試験登録番号:UMIN000014616)
- 血漿中のDNA integrityはペプチドワクチン療法を受けた子宮体がん患者において予後予測因子となる
-
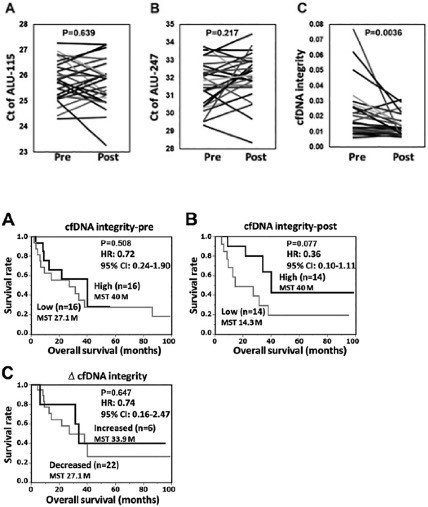
子宮体がんは先進国の婦人科癌のうち最も発症数の高い癌です。ほかの婦人科癌に比べて予後は良いのですが、進行期における予後は依然とし悪く、免疫療法のような新たな治療法が早急に必要とされており、新たなバイオマーカーの探索も重要となっています。本研究では、ペプチドワクチン療法を受けた進行期の子宮体がん患者における血漿中DNA integrity (血漿中の総DNA断片に対するネクローシスで生じた長いDNA断片の比率)を検討しました。ペプチドワクチン後における血漿DNA integrityの減少、及びペプチドワクチン後の血漿DNA integrityが予後と相関していることが確認されました。前者は他の癌腫でも同様の傾向が見られたことにより、血漿DNA integrityはがんワクチン療法における重要なマーカーとなる可能性が示唆されました。
本研究の成果はMol Clin Oncol. 2021 Feb;14(2):29. doi:10.3892/mco.2020.2191.に公表されました。
- 血漿中のDNA integrityはペプチドワクチン療法を受けた非小細胞肺がん患者において予後予測因子となる
-
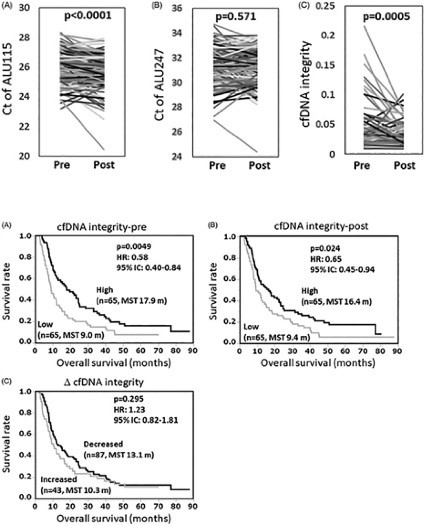
免疫チェックポイント阻害剤を用いた併用療法の臨床試験が多く行われており、その組み合わせ療法としてワクチン療法が期待されています。我々はテーラメイドペプチドワクチン療法を開発し、多くの癌腫で臨床試験を行ってきましたが、予後予測因子となるバイオマーカーはまだ限られており、新たなバイオマーカーの探索が必要とされています。本研究では、ペプチドワクチン療法を受けた進行期の非小細胞肺がん患者における血漿DNA integrityを検討しました。ワクチン1サイクル後に血漿DNA integrityの減少が確認され、ワクチン前の血漿DNA integrityが高値の患者は低値の患者より予後が長く、中央値はそれぞれ、17.9カ月と9カ月でした(hazard ratio: 0.59, p=0.0049)。ワクチン後の血漿DNA integrity値でも同様の傾向が見られました(中央値:16.4カ月と9.4カ月、hazard ratio: 0.65、p=0.024)。以上より、がんペプチドワクチン療法を受けた非小細胞肺がん患者において血漿DNA integrityが予後予測マーカーとなりうることが示唆されました。
本研究はImmunopharmacol Immunotoxicol. 2021. 43(2):176-182. Doi:10.1080/08923973.2021.1872619.に公表されました。
- 膵臓がんにおけるテーラーメイドペプチドワクチン療法の低臨床効果に関する因子の検討
-
309名の膵臓がん患者(301名が進行期がん)を対象としたテーラーメイドペプチドワクチン療法の臨床第Ⅱ相試験を行いました。ワクチン候補ペプチド31種の中からHLAタイプと各ペプチドに対する血中IgGの抗体価をもとに2から4種のペプチドを選択し、皮下投与しました。309名のうち、81名が急速な疾患進行のためワクチン1サイクルを終えられず、全生存の中央値は2.1カ月と1サイクル終了した228名の8.4カ月と比較し大幅に短いことが確認されました(p<0.01)。「免疫ブースティング」をワクチン後にIgGレベルがワクチン前の2倍以上になる、と定義した場合、化学療法との併用の有無にかかわらず、大多数の患者で免疫ブースティングが見られました。また、31種のペプチドに対する免疫反応は様々でしたが、投与ペプチドに対する免疫ブースティンを示した患者はより長い生存期間が確認されました。低臨床効果に関するワクチン前因子として、高値のC反応性タンパク質レベル、高好中球カウント数、低リンパ球数と低赤血球数、進行期、ワクチン前の化学療法の多さが関与していました。ワクチン後因子として、ペプチドワクチンの単剤療法及び免疫ブースティングの低さが関与していました。以上より、すい臓がんにおけるペプチドワクチン療法の低臨床効果は、ワクチン投与前の炎症シグネチャーが関与していることが示唆されました。
本研究の成果はMol Clin Oncol. 2021 Feb;14(2):39. doi:10.3892/mco.2020.2201.