現在、私たちは難治癌の診断・治療、および硬変肝の再生を2つの柱として研究活動を展開しています。前者には、1)腫瘍組織内皮細胞特異的に発現するマイクロRNAの同定とそれを標的とした腫瘍特異的血管新生抑制療法、2)膵液由来エクソソームのmicroRNA解析による膵癌高精度早期診断、3)Wntシグナル転写因子TCF-4アイソフォームによる癌幹細胞形質発現制御機構の解明、4)肉腫様肝癌における免疫補助シグナル分子PD-L1の発現および新規機能解析、5)マルチキナーゼ阻害剤による肝癌腫瘍免疫の改変、6)肝癌に対する分子標的治療におけるIGFBP-1のバイオマーカーとしての意義が含まれます。後者には、自己CD34陽性血管内皮前駆細胞によるC型肝硬変の再生治療が含まれます。
2017年度、久留米大学は文部科学省の「私立大学研究ブランディング事業」に採択されました。先端癌治療研究センター・肝癌部門はその事業の一翼を担っています。本事業は、2019年度で終了しましたが、本事業によってサポートされた膵液エクソソームプロジェクトからは、特許申請可能な有望な知見が得られました。
部門長 古賀浩徳
- A.「TCF-4 isoform高精度発現解析による肝癌特異的Wntシグナル異常の探求」
-
主研究者:古賀浩徳
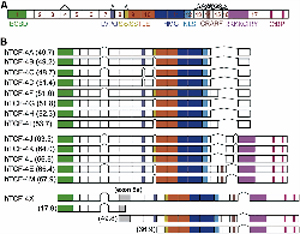
我々はWntシグナル中枢転写因子T-cell factor (TCF)-4のisoformを,ヒト肝癌細胞株から14クローン(新規12)同定した(図1)(Exp Cell Res 2011).機能解析の結果,Exon 9の先頭に位置する転写制御モチーフ「SxxSS」が肝癌細胞の造腫瘍能や低酸素耐性に(PLoS ONE 2012),またExon 4全体の欠失が抗癌剤耐性や上皮間葉移行に関わっていることを見出した(Liver Int 2013).従って,各isoformの発現量や比が肝癌形質の多彩さを調節していることが示唆されたが,肝癌組織における我々のisoform発現解析には,定量性に限界があった.本研究ではこの限界を超えるべく,ペプチド核酸(Peptide Nucleic Acids, PNA)を用いた新しいPCRシステムで,個々のisoform mRNA発現の正確な定量法を確立した.
種々のヒト癌細胞を用いて4種のTCF-4 isoform(A, B, J, K)を測定した.使用した細胞は,ヒト肝細胞癌細胞株(HAK-1A, HAK-1B, Hep3B),胃癌細胞株(MKN74),膵癌細胞株(PANC1, BxPC-3),大腸癌細胞株(HCT-119, HT-29)の8種類である.胃癌や大腸癌でJ型の発現が高いことがわかった.このJ型 は,これまで我々が肝癌の悪性化と関連するisoformとして注目してきたタイプである(Exp Cell Res 2011; PLoS One 2012; Cancer Lett 2013).この結果を踏まえ,さらに特徴的形質を持った5種の肝癌細胞株(HAK-5(肉腫様肝癌),KMCH-1, KMCH-2(混合型肝癌),HepG2(肝芽腫))とヒト胎児由来不死化肝細胞 (OUMS-29)においてもisoform解析を行った.その結果,J型はHepG2やOUMS-29でも比較的強い発現が見られた.腺癌形質を有する混合型肝癌ではJ型の発現増強 は見られなかった.肝よりもむしろ胃や大腸などの消化管癌のほうがTCF-4 J型が強く発現しており,Wnt/beta-catenin/TCF-4経路の活性化とJ型の発現に相関があることが示唆された.また,TCF-4 isoformのプロファイリングを行うことで,canonical pathwayが活性化している癌(大腸癌や胃癌)とそうでない癌(肝癌や膵癌)とに分けることができる可能性が示唆された.
- B.CD34陽性細胞移植はNASHモデルマウスの肝線維症を改善させる
-
主研究者:中村 徹、増田 篤高
【背景】肝硬変を原因別にみるとC型肝炎が主な原因だが、年々非アルコール性脂肪肝炎(NASH)の比率が上昇しており、近い将来肝硬変の主要原因になることが予想されている。これまでに我々は四塩化炭素(CCl4)誘導肝硬変モデル動物を用いて、CD34陽性細胞移植により肝線維化は抑制され、肝再生が促進することを報告した。CCl4誘導に伴う肝線維化と、脂肪肝の進行に伴うものでは、その成因や形態学的な肝線維の蓄積様相は大きく異なる。本研究では、培養CD34陽性細胞移植が食餌誘発性NASHモデルマウスに有効であるか否かを検証した。
【方法】CD34陽性細胞はC57BL6/Jマウス骨髄単核球層より磁気細胞分離装置を用いて分離し、各種成長因子(VEGF, SCF, IL-6, Flt-3, TPO)を添加したStemSpan-SFEM培地で7日間培養した。増幅したCD34陽性細胞をFCM分析によって評価した。C57BL /6Jマウスには、通常食(NF, 10%kcal脂肪)またはコリン欠乏メチオニン減量高脂肪食(CDAHFD60)を8週間給餌することでNASHモデルマウスを作製した。9週目の時点で、マウスを以下の5群に群別した:グループA:NF+生食水投与群、グループB:NF +単回移植群、グループC:CDAHFD60 +生食水投与群、グループD:CDAHFD60 +単回移植群、グループE:CDAHFD60 +2回移植群。給餌開始9週目に経脾的に生食水あるいはCD34陽性細胞を移植し、2回移植群では11週目に2回目の細胞移植を行った。細胞移植後もCDAHFD60の給餌を継続し、給餌開始12週目終了時に全てのマウスを屠殺し解析した。解析は血液生化学検査による肝機能評価、アザン・マロリー染色による肝線維化評価、さらにリアルタイムPCRにて肝線維化関連遺伝子発現を評価した。
【結果】7日間の培養にて、CD34 陽性細胞は効果的に増殖できた。増幅したCD34 陽性細胞は、CD31およびCD34の細胞表面マーカーが陽性であるのに対し、F4/80は陰性であった。CDAHFD60の給餌によりマウスは肝線維症を発症し、AST、ALT、T-Bil値はA群とB群よりもC群で有意に高く、2回移植することによりALT値は優位に低かった。培養CD34陽性細胞を2回移植することにより肝線維化の程度は減少し、半定量分析において肝線維化率はグループCの7.4 ± 0.6%と比較し、グループEでは5.2 ± 0.3%と優位に低値を示した。リアルタイムPCRにおいてCol1a1、Acta2、TGFb1、およびTimp1のmRNA発現はグループAおよびBと比較し、グループCで有意に増加した。しかし培養CD34 陽性細胞を2回移植することにより、Col1a1のmRNA発現が大幅に減少し、Timp1のmRNA発現も減少傾向を認めた。
【結語】培養CD34陽性細胞を繰り返すことにより、肝線維化抑制作用を持つことが明らかとなった。NASHに伴う新規抗線維化治療法として期待できる。図 肝臓切片のアザン・マロリー染色写真。
培養CD34陽性細胞を2回移植することにより肝線維化の程度は優位に減少し、半定量分析において肝線維化率はグループCの7.4 ± 0.6%と比較し、グループEでは5.2 ± 0.3%と優位に低値を示した。グループA:通常食(NF)+生食水投与群、グループB:NF +単回移植群、グループC:CDAHFD60 +生食水投与群、グループD:CDAHFD60 +単回移植群、グループE:CDAHFD60 +2回移植群。Bar = 100mm。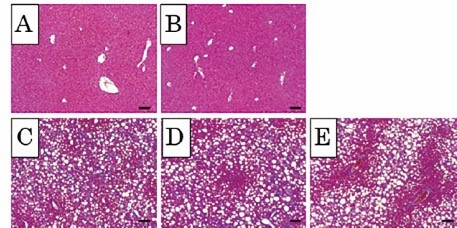
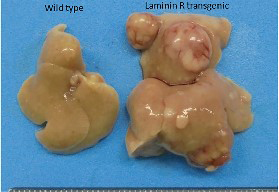
- C.非アルコール性脂肪性肝炎における肝線維症および肝発癌に対するラミニン受容体の機能解析。
-
主研究者:吉田隆文
我々はこれまでに肝細胞癌におけるラミニン受容体の発現亢進が、組織学的ハイグレードおよび門脈浸潤といった生物学的悪性度と関連していることを報告した。さらに背景肝組織におけるラミニン受容体高発現は、独立した予後不良因子であり、血清アルブミン値と有意に相関していた。この研究では、ラミニン受容体の高発現が非アルコール性脂肪性肝炎における肝線維化と肝発癌を促進するかを解析した。ラミニン受容体トランスジェニックマウスにおいて非アルコール性脂肪性肝炎モデルを作成し組織学的および生化学的解析を行った。免疫組織化学染色および定量的リアルタイムPCRの結果から、ラミニン受容体の高発現は肝炎と肝線維化を促進することが示された。また、肝発癌もラミニン受容体トランスジェニックマウスにおいて有意に増加していた。ラミニン受容体は非アルコール性脂肪性肝炎に対する治療標的となる可能性が考えられた。
- D.切除不能進行肝細胞癌におけるレンバチニブの薬剤耐性に癌関連線維芽細胞(Cancer associated fibroblast)が関与する
-
主研究者:岩本英希
【目的】
切除不能進行肝細胞癌(HCC)に対するレンバチニブ(Len)は一次治療薬として注目されている。LENはVEGFシグナルの抑制に加え、FGFシグナルを抑制する事で、癌血管新生を抑制する薬剤である。LENは奏効性の高い薬剤であるが、HCCは経過によりLENに対する薬剤耐性を獲得し、再度増悪する症例を数多く経験する。癌関連線維芽細胞(Cancer associated fibroblast: CAF)は癌微小環境を構成する重要な細胞群であり、これまでの報告から薬剤耐性、腫瘍進展などに深く関わる事が報告されていた。今回、我々はHCCのLenに対する薬剤耐性の獲得メカニズムとCAFの関与をマウス肝癌モデルを用いて基礎的に検証した。【方法】
肝癌担癌マウスモデルにソラフェニブ及びLenを投与し、治療後の組織の癌微小環境の変化を免疫染色法で評価する。治療後の組織から、ビーズ吸着法でCAFの細胞分画を単離し、遺伝子発現解析を行う。線維芽細胞株に対して、ソラフェニブ及びレンバチニブを投与し、線維芽細胞株の遺伝子発現変化を検証する。【結果】
肝癌担癌マウスモデルにおいて、ソラフェニブ及びLen投与群は著明な癌血管の減少を認めた。加えて、間質細胞のマーカーであるα-smooth muscle actin(α-SMA)を用いた染色で治療群において、α-SMA陽性領域が著明に増加していた。α-SMA陽性領域の主な細胞群はCAFと考えられる。加えて、LEN投与後の腫瘍組織の遺伝子発現変化を評価したところ肝細胞増殖因子(HGF)及びその受容体であるc-METが治療後に著明に増加していた(図1)。単離されたCAFは著明にHGFを発現していた。線維芽細胞株を用いたin vitroの実験系での評価で、Lenは直接、線維芽細胞株のHGFの発現を増加させる事が分かった。追加実験により、LenによるFGFシグナルの抑制が直接的に線維芽細胞のHGFの増加をもたらす事が明らかになった。HGFは肝癌細胞株の形態変化をもたらす事が示された。また、低酸素環境はHCCにc-MET発現増加を促す事も確認された。【結語】
本研究によりHCCにおけるLen薬剤耐性獲得のメカニズムの一端が明らかになった。Lenによる癌血管新生抑制は癌微小環境に低酸素をもたらす事で、HCCはc-METの発現を増加させる。一方でLenによるFGFシグナルの抑制はCAFに対して、直接的にHGFの増加をもたらす。その結果、Len投与におけるHGF-c-METシグナルの活性はHCCに薬剤耐性をもたらすことが明らかになった。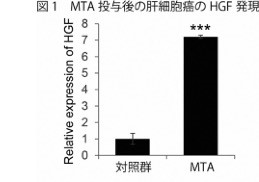
図1 MTA投与後の幹細胞癌のHGF発言
- E.「NASH治療を目的とした革新的DDS製剤の創出」
-
主研究者:増田篤高、中村 徹
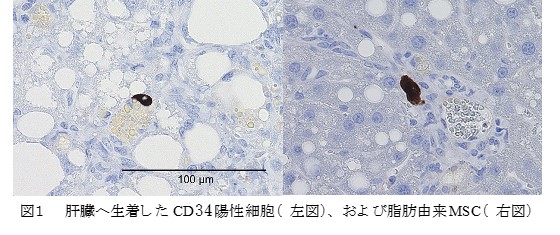
【背景】我々はこれまでに肝硬変に対するCD34陽性細胞移植による抗線維化、肝再生促進治療に関する基礎研究から臨床研究まで行ない、治療効果を報告してきた。その結果、経門脈的に投与されたCD34陽性細胞は、硬変肝に選択的にhomingし、生着することがわかった。本研究はCD34陽性細胞のhoming能力を利用し、移植細胞に導入した薬剤を肝臓選択的に届けるドラッグデリバリーシステムの創出を目的としている。そこで、まずは移植細胞の肝生着率を算出できるin vivoモデルを作製し、脂肪由来MSCを対照とし、肝生着率を比較検討した。
【方法】マウスCD34陽性細胞はGFP-tgマウス骨髄単核球細胞より磁気細胞分離システムを用いて分離し、VEGF,SCF,IL-6,Flt-3 ligand,TPOを添加したStemSpan-SFEM培地にて7日間培養したものを用いた。脂肪由来MSC(Ad-MSC)はマウス鼠径部皮下脂肪より採取し、10%FBS/DMEM F12メディウムにて5継代培養し純化した。培養CD34+細胞およびAd-MSCをFCM解析により評価した。C57BL/6J雄性マウス6週令に通常食あるいはコリン欠乏メチオニン減量60%脂肪食(CDAHFD60)を16週間給餌させ、NASHモデルマウスを作製した。両細胞を経脾的に細胞移植し、移植後2日後にすべてのマウスを屠殺し、肝臓を採取し、肝体積を測定後ホルマリン固定した。肝臓切片を抗GFP抗体を用いて免疫染色し、面積当たりのGFP陽性細胞数、GFP陽性細胞の細胞長径を測定し、移植細胞の推定肝生着率を算出した。
【結果】FCM解析にて、培養CD34陽性細胞はCD31+, CD45+, F4/80-であった。Ad-MSCはCD44+, CD90+, CD45-. CD31-であり、CD73, CD105の陽性率は既報に比べやや低値であった。肝臓切片にて観察されたGFP陽性細胞の長径は培養CD34陽性細胞: 9.3μm、Ad-MSC: 33.8μmと大きく異なっていた。算出された培養CD34陽性細胞の肝生着率は通常食群に比べCDAHFD60群で優位に増加し(17.5% vs 38.5%)、さらにAd-MSCと比較しても優位に多かった(38.5% vs 30.2%)。
【結語】細胞長径が大きく異なる細胞同士であっても、肝生着率を算出し比較検討することができるin vivoモデルを開発した。CD34陽性細胞は肝臓に代謝性ストレスを与えることでより強く肝臓にhomingし、その能力はAd-MSCと比較しても強力であると考えられた。
- F.エクソソーム由来膵癌特異的microRNAを用いた早期診断法の開発
-
主研究者:阪上尊彦、岩本英希、古賀浩徳
膵癌は極めて予後不良な悪性腫瘍の一つであるが、早期発見・治療ができれば、良好な予後が期待できる。これまでのバイオマーカーに関する膵癌エクソソームの検討のほとんどは血清を利用したものであるが、実用化に至っていないのが現状である。
本研究では、より病巣と密接に関係する膵液中から膵癌特異的なエクソソーム中microRNAを探索・同定し、画像検査では認識できない前癌病変や早期膵癌を、既知の腫瘍マーカーや細胞診よりも優れた感度・特異度をもって診断することを目的とする。
我々は独自の手法を用いて、二つの膵液中エクソソーム由来膵癌特異的microRNAの同定に成功した。その後、膵癌患者膵液 15 例、慢性膵炎患者膵液 11 例を用いて検証したところ、既存の腫瘍マーカーや膵液細胞診よりも高い感度・特異度・正診率を示した。さらに、膵液細胞診に、この二つのmicroRNA を上乗せすることによって、より膵癌診断のバイオマーカーとして有用であることが示された。また、血清診断への応用に関する少数例での検討では、有望な結果が得られ、さらに、膵癌根治切除後の血清においてエクソソーム中microRNAの発現が低下していることから、治療効果モニタリングとしての有用性も示唆された。現在、これらエクソソーム中microRNAの機能解析を行なっている。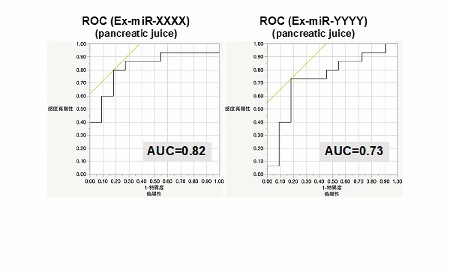
- G.抗PD-L1抗体薬は、肝癌細胞のPD-L1依存性に膜受容体を介して増殖を促進する
-
主研究者:田中俊光、古賀浩徳
【背景と目的】がん薬物療法において、PD-1/PD-L1などを標的とする免疫チェックポイント阻害剤(ICI)の有効性が明らかになっている。しかしながら、免疫チェックポイント阻害剤である抗PD-1/PD-L1抗体使用後に一定の割合で腫瘍が急速に増大する症例(hyperprogressive disease,HPD)が存在することが報告されている。これまでのところ、HPDの発現機序ははっきりしていない。今回我々は、ヒト肝癌細胞株におけるPD-L1の発現を検討し、抗PD-L1抗体薬を投与後に細胞増殖が亢進するかどうかを評価し、その増殖に関わる分子機構を検討した。
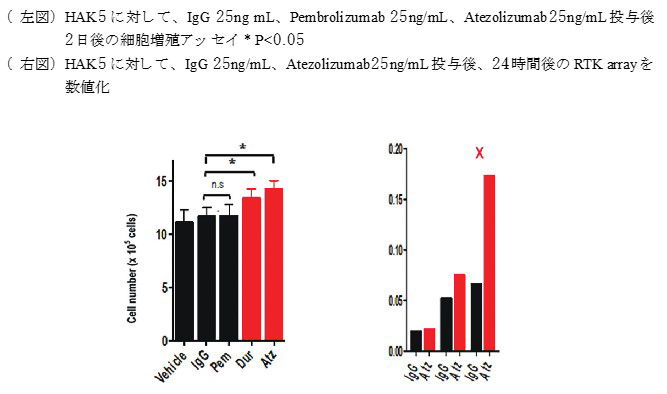
【材料と方法】ヒト肝癌細胞株Huh-7、Hep3B、HepG2、HLFの他、久留米大学病理学講座で樹立された肝癌細胞株(HAK-1A, HAK-1B, KMCH-1, KMCH-2, KYN-1, KYN-2, HAK-5)およびヒト胎児由来不死化肝細胞株(OUMS-29)、合計12種類を用いた。PD-L1の発現はwestern blotおよびreal-time PCRで評価した。さらに、PD-L1ノックダウン細胞株とPD-L1過剰発現株を樹立して、抗PD-L1抗体薬(atezolizumab、durvalumab)を投与して、細胞増殖に差があるかどうかを検討した。次にHAK5において、抗 PD-L1 抗体薬投与後にリン酸化 RTK Array Kit を用いて、PD-L1 と共役する標的可能な RTK を探索した。
【結果】上記細胞株において、HLF、HAK5でPD-L1の発現を認め、さらにHAK-5で極めて強いPD-L1の発現を認めた。次にHAK5に対して、抗PD-L1抗体薬(atezolizumab、durvalumab)を投与すると、細胞増殖が約20%程度亢進した。さらに他の細胞株(Huh7、HepG2、HLF)に対して、atezolizumabを投与すると、Huh7、HepG2では、細胞増殖能に変化を認めなかったが、HLFで細胞増殖が有意に亢進しており、PD-L1の発現量で細胞増殖能に違いがあることが明らかになった。さらにPD-L1をノックダウンしたHAK-5細胞株に対して、atezolizumabを投与すると、対照と比べPD-L1ノックダウン細胞株で細胞増殖能が有意に低下していた。次にHepG2においてPD-L1過剰発現株を樹立して、atezolizumabを投与すると、対照と比べPD-L1過剰発現株で有意に細胞増殖能が亢進した。
RTK Arrayでは、atezolizumabを投与すると膜レセプターXの発現が上昇していた。【結論・展望】ヒト肝癌細胞株に対して、HLF、HAK5がPD-L1の発現を認めており、抗PD-L1抗体薬を投与すると、細胞増殖能が亢進することがわかった。さらに、PD-L1の発現量の違いで、抗PD-L1抗体薬投与すると細胞増殖能に違いがあることが明らかなになった。増殖に関わる分子としてXが同定された。今後は、同定されたXの作用機序の解明を行っていく。
- H.分子標的薬治療によりimmune coldな腫瘍である肝細胞癌をimmune hotな腫瘍へと変える可能性がある
-
主研究者:鈴木浩之、岩本英希
【背景】
現在、進行肝細胞癌 (HCC) 治療においてソラフェニブ・レンバチニブ等の分子標的治療薬 (MTA) が治療に用いられているが、満足な治療効果が得られているとは言い難い。最近、HCCに対する治療として免疫チェックポイント阻害剤 (ICI) とMTAを組み合わせた治療の抗腫瘍効果の高さが評価されており、今後のHCC治療に期待が集まっている。しかしながら、その組み合わせによって得られるメカニズムについては不明な点が多く、最大限の治療効果が得られる患者選択が困難でることが現状である。
HCCは元来、その免疫微小環境はimmune coldな腫瘍として知られ (Wada et al. Hepatology 1998)、さらにimmune coldな腫瘍はICIに対し治療抵抗性があるとされている。ICIを用いたHCC治療戦略においてimmune coldな腫瘍をimmune hotな腫瘍へと変えることは非常に重要であると考えられる。【方法】
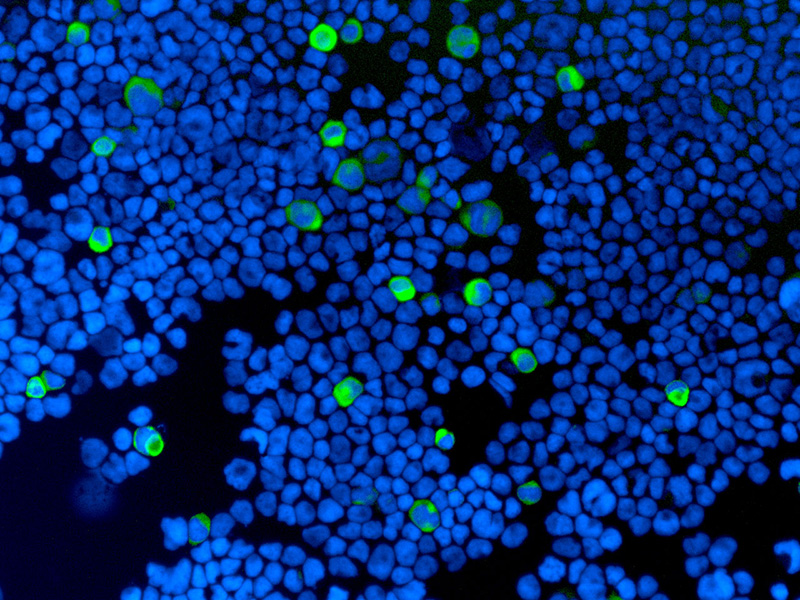
我々はC57BL/6マウス由来の肝癌細胞株をC57BL/6マウスの背側皮下もしくは肝左葉に移植することにより肝細胞癌の免疫同系統マウスモデルを作製した。腫瘍の生着を確認後に経口MTA治療を行った。MTA治療によって免疫微小環境がどのように変化したかを評価するため、免疫組織化学染色を用いて、免疫剤担当細胞の細胞表面マーカーを染色し、高倍率視野中に存在する免疫担当細胞数を測定した。【結果】
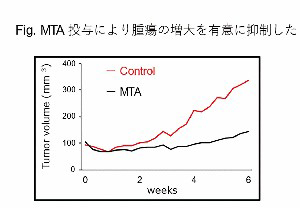
コントロール群と比較してMTA治療群の腫瘍の増大速度は有意に抑制された。コントロール群では免疫担当細胞数の数は少なく、ヒトHCCと同様に免疫同系統肝癌マウスモデルでも腫瘍免疫微小環境はimmune coldであることが示唆された。MTA治療群では、コントロール群と比較してCD8陽性リンパ球やCD4陽性リンパ球などの免疫担当細胞数の有意な増加を認め、MTAが腫瘍免疫微小環境をimmune coldからhotに変化させたことが示唆された。【結論】
HCCの免疫同系統肝癌マウスモデルにおいて、MTAは腫瘍免疫微小環境をimmune‘cold’から‘hot’へと変化させた。MTAがimmune‘cold’なHCCをimmune‘hot’な腫瘍へと変化させ、そこにICIを組み合わせることで、相乗効果が得られている可能性を本研究では示した。我々はMTAにより変化したリンパ球に着目し、Auto MACS®を用いて腫瘍中からリンパ球を分離し、解析を行っていく。