分子標的部門は現在10グループ(呼吸器・神経・膠原病内科グループ、消化器外科グループ、肝胆膵外科グループ、産婦人科グループ、脳神経外科グルーブ、整形外科グループ、放射線科グループ、血液腫瘍内科グループ、病理学グループ、病院病理部グループ)で構成されている。
各グループが独立性を保ちつつ、特色のある研究活動を行っている。複数のグループで第4の標準治療とされる免疫チェックポイント阻害剤および腫瘍免疫環境に検討が盛んに行われている。また、がんゲノム医療における検体の取り扱い・データの解析による新規バイオマーカーに関する検討も行われている。これらは、現在の医療情勢を色濃く反映しているもので、実際の治療に還元できる結果の創出が期待される。さらには、iPS細胞や培養細胞を用いた検討も展開され、今後、from bench to bedへの展開が期待される。
各グループで得られた結果をさらに発展させ、複数のグループより構成される分子標的部門の特色を生かし臓器横断的ながんの治療に結び付けることを目標としたい。
部門長 秋葉 純
- 食道扁平上皮癌におけるT細胞レセプターレパートリーの多様性と共有レパートリの解析
-
主研究者:主藤朝也、河原明彦、石井一夫、溝口充志、長主祥子、
中川将視、藤崎正寛、日野東洋、最所公平、加耒秀彰、
的野 吾、森 直樹、秋葉 純、山田 亮、赤木由人[研究背景]
腫瘍細胞に対する免疫の反応は、腫瘍微小環境に浸潤したT細胞上に発現しているT細胞レセプター(TCR)のレパートリーと腫瘍細胞との相互関係に依存している。我々は、食道扁平上皮癌(ESCC)において腫瘍病変局所に存在するT細胞上のTCRレパートリーの多様性と、共有されたTCRレパートリーの存在を探索した。本研究を通して、免疫治療の有効性の予測や新たな免疫治療の可能性を探る。
53例の食道癌切除症例が本研究にエントリーした。免疫組織化学染色をCD3,CD8,CD45RO,FOXP3,CD274,HLA class I,AE1/AE3に関して行った。デジタル病理学診断によりそれぞれのマーカーの発現量を解析した。マーカーの発現値を使用し、K-meansクラスタリング解析による探索的なグループ分けを試みた。グループ分けしたimmuno relation high(IR-Hiグループ)とimmuno relation low(IR-Loグループ)との間で臨床病理学的因子に関して統計学的解析を行った。アダプター結合PCRを施行し増幅したTCRレパートリーについて次世代シークエンサー(NGS)を用いた包括的なTCRレパートリー解析を施行した。さらにIR-HiグループにおいてT細胞サブセットマーカーを使用し、階層性クラスタリング解析を行いIR-Hiグループでのさらなるサブグループ解析を行った。
エントリーした症例はK-meansクラスタリング解析により、IR-Hiグループ21例、IR-Loグループ32例に分別することができた。IR-Hiグループではリンパ管浸潤が有意に少なかったが、双方のグループ間で他に有意差を認める臨床病理学手因子は認められなかった。IR-HiグループはIR-Loグループと比較し有意にIR-HiグループとIR-Loグループからそれぞれ5例づつをランダムに抽出しグループ間でTCRレパートリー非類似性解析(Repertoire dissimilarity index :RDI)を施行したところ、IR-HiグループはIR-Loグループと比較し有意に豊富なTCR多様性を有した。また、IR-Hiグループでは共有された27種類のTCRαVJ組み合わせ配列と23種類のTCRβVJ組み合わせ配列が認められた。本研究を通して、食道扁平上皮癌症例にはIR-HiグループとIR-Loグループが存在し、IR-HiグループではTCRレパートリーが豊富に認められ、症例間で共有されたTCRαβVJ配列の存在の可能性を明らかにした。
- ゲノム機能に基づく抗がん剤感受性・耐性関連遺伝子群の解明
-
主研究者:緒方 傑、信國好俊、主藤朝也、赤木由人
背景:がん治療を考える上で、抗がん剤への感受性ならびに耐性は重要な課題である。抗がん剤感受性・耐性に関与する遺伝子群は多数存在すると考えられているが、未だ十分には解明されてはいないのが現状である。
目的:今回、我々は大規模ジーントラップ挿入変異細胞ライブラリーを用いたゲノム機能学的責任遺伝子の包括的探索法よって、抗がん剤感受性・耐性に関与する遺伝子群の解明を行う。具体的には、イリノテカンの殺細胞性抗がん剤について感受性・耐性に関与する遺伝子群の探索と機能解析を進める。
研究の計画と方法:(1)抗がん剤感受性低下変異細胞群の濃縮と単離:大規模ジーントラップ挿入変異細胞ライブラリーの抗がん剤処理と生き残った細胞の増幅を3回繰り返すことで、抗がん剤感受性低下変異細胞のプールを作製する。この細胞プールの中には、ジーントラップ挿入変異によって抗がん剤感受性の低下した変異細胞が多数含まれことが予想される。これらの細胞プールを希釈培養することで変異細胞の単離を行う。(2)変異細胞の遺伝子群の解明:上記抗がん剤変異細胞8クローン、Wild type細胞4クローンから、5’-RACE/シークエンス/BLAST解析によって発現遺伝子を解析する。(3)遺伝子発現の差を統計学的に明らかとし、耐性への関与が示唆される機能学的特徴を考察する。
予想される結果:イリノテカンについての耐性関連遺伝子を解明できれば、抗がん剤耐性克服へむけた新たな手掛かりにつながると期待される。
- 大腸癌肝転移におけるImmuno-nutritional statusとTumor infiltrating lymphocytesの関連性の検討
-
主研究者:菅野裕樹、久下 亨
【背景】
腫瘍浸潤リンパ球(TIL: tumor infiltrating lymphocytes)の多寡が様々な癌の予後に影響を与えていると報告されている。実際に、我々は大腸癌(特に右側結腸癌)においてTIL高発現が予後良好であることを報告した(Kanno H,et al. Cancer Science.2020;111:3032–3044)。また、術前免疫栄養状態(INS: Immuno-nutritional status)が術後合併症や長期予後と正の相関を示すとの報告が散見される。INSの評価としては以下の指標が挙げられる〔controlling nutritional score(CONUT),geriatric nutritional risk index(GNRI), prognostic nutritional index (PNI),Glasgow prognostic score(GPS),C reactive protein albumin ratio (CAR)〕。これらは一般採血項目や体重を用いて非常に簡便に算出される。近年、我々は術前GNRI scoreが肝細胞癌患者の長期予後と相関することを報告した(Kanno H,et al.Scientifc Reports(2021)11:9038)。
INSが術後合併症や長期予後と相関する理由として、癌局所では腫瘍免疫が活性化している可能性を考えている。すなわちINSが良好なpopulationではTILが高発現していると推測している。従って、今回、大腸癌肝転移巣でのINSとTILの関連性の検討を行う。
【方法】
患者:2005年~2019年の間に大腸癌肝転移に対して初回肝切除を受けた145名
Immuno-nutritional score: CONUT,GNRI,PNI,GPS,CAR,neutrophil lymphocyte ratio(NLR),platelet lymphocyte ratio(PLR),lymphocyte monocyte ratio(LMR)を算出し、各指標をhigh群/low群に2群化し、術後合併症および予後との関連を検討する。
Immunohistochemistry: 上記患者のFFPE標本を用いて腫瘍先進部および腫瘍中心におけるTILのカウントを行う。抗体はCD3,CD4,CD8,FoxP3を用いる。また腫瘍免疫に強い影響を与えるとされるmismatch repair protein(MMR)statusの検討も加える(MLH1,MSH2,MSH6,PMS2)。TILカウントはImage Jソフトを用いて行う。今後上記で算出したINS、TILカウントおよび臨床情報との関連性の検討を行う。
- CD47 およびSIRPαの発現に関する軟部肉腫の臨床病理学的検討
-
主研究者:中田路子、平岡弘二、濱田哲矢、松田光太郎、
三好寛明、大島孝一、志波直人マクロファージや樹状細胞に発現するシグナル調節タンパク質アルファ(SIRPα)は、標的細胞に発現するCD47と結合することで、“don’t eat me signal”が伝達され、標的細胞の貪食を阻害することから免疫チェックポイントとして認識されている。近年これらの発現は、いくつかの悪性腫瘍において臨床病理学的特徴と関連していることが示され、この貪食回避シグナル系を標的とした薬剤の有効性が明らかになっている。軟部肉腫(STS)との関係は十分な検討がなされていない。本研究は、STSにおけるCD47とSIRPαの発現と臨床病理学的特徴との関連を明らかにすることを目的とした。対象は当科にて加療した軟部肉腫128例。内訳はLeiomyosarcoma(LS)21例、Undifferentiated pleomorphic sarcoma(UPS)34例、Dedifferentiated liposarcoma(DDLS)7例、Myxoid liposarcoma(MLS)17例、Myxofibrosarcoma(MFS)17例、MPNST13例、Synovial sarcoma(SS)8例、ASPS6例、Extraskeltal osteosarcoma7例であった。手術で採取された検体のホルマリン固定標本を使用し、免疫組織化学的染色を用いてCD47およびSIRPα発現を調べ、臨床病理学的特徴との関連を統計的に評価した。CD47は主に腫瘍細胞で発現し、SIRPαは非腫瘍性の間質細胞で発現していた。腫瘍細胞のうち、CD47染色陽性の腫瘍細胞の割合を評価した。SIRPα染色では、染色された間質細胞の数をカウントした。組織型ごとにそれぞれの中央値で高発現群と低発現群に分けた。予後解析はKaplan-Meier法を用い、全生存率、無増悪生存期間の分析を行った。UPSではCD47高発現群では60歳以上(p=0.0743)、腫瘍径5㎝以上(p=0.0660)、FNCLCC grade 3(p=0.0660)の割合が高い傾向がみられた。LMSではCD47高発現群は女性の割合が高い傾向がみられ(p=0.0805)、MPNSTではFNCLCC grade2の割合が高い傾向がみられた(p=0.0517)。SIRPα高発現群において、LMS(p=0.0128)、MPNST(p=0.0179)、ASPS(p=0.0253)では、全生存率(OS)における予後が有意に悪かった。MPNSTではCD47、SIRPαどちらも高発現群においてはOSが有意に悪かった(p=0.0005)。我々の結果は、SIRPα発現が腫瘍の微小環境において重要な役割を果たしていることを示唆し、有効な分子標的薬の適応となる可能性を示唆している。今後、さらなる病態の解明と分子標的治療薬の適応に関する研究が行われることが期待される。
- 子宮内膜癌におけるMELFパターンの研究
-
主研究者:朴 鐘明、津田尚武、那須洋紀、勝田隆博、
田崎和人、寺田貴武、西尾 真、駒井 幹、
真田咲子、牛嶋公生研究背景:
子宮体癌(類内膜癌)におけるMELFパターンはMELF は,腫瘍腺管による微小囊胞様(microcystic)空隙の形成,腫瘍腺管の延長(elongated),断片化(fragmented)によって特徴づけられる。そして、MELFパターンは類内膜癌Ⅰ期におけるリンパ管侵襲やリンパ節転移との相関が報告されている。しかしながら、その予後との関連は不明であり、術前にⅠ期が想定される高分化型子宮体癌では骨盤内リンパ節郭清が省略されることもあり、臨床的に治療方針を決定する重要なパラメーターである。研究目的:
本研究の目的は高分化型の進行期Ⅰ期子宮内膜癌におけるMELFパターンの頻度と他の予後因子との関連・MELF有無による再発との相関を調査することである。方法:
2016~2020年において久留米大学病院婦人科で子宮摘出術を施行した127例の子宮体部限局型の高分化型I期類内膜癌において、リンパ管侵襲、筋層浸潤、リンパ節転移(骨盤、傍大動脈リンパ節)、MELFパターンの有無に関して検討した。また、年齢、後治療の有無、無病生存期間、全生存期間、再発、再発後の治療に関しても検討した。すべてのMELFパターンの出現を検討する病理標本は2名の婦人科腫瘍医、1名の婦人科腫瘍専門の病理医により診断を確認した。結果:
摘出子宮内で子宮体部限局型pT1類内膜癌Grade1または2において、17/127例(13.4%)のMELFパターンを認め、筋層浸潤1/2未満では8/17(47%),1/2以上では9/17例(53%)にMELF patternを認めた。MELF陽性者の内、リンパ管侵襲は11/17名(65%)に認めた。リンパ節転移は6/17名(35%)で認め、うち筋層浸潤1/2未満では3/6例(50%)に認め、1/2以上では3/6例(50%)に認めた。再発は2/17名(11.8%)に認め、両名とも傍大動脈リンパ節転移であった。無病生存期間は中央値3.5ヶ月で1名の原癌死を認めた。(1/17:死亡率0.59%)結論:
MELFパターンを伴う高分化型Ⅰ期類内膜癌は高率にリンパ節転移を認めた。MELFパターンは術前の画像診断でⅠ期を疑うが故にリンパ節転移を省略する症例において、リンパ節切除を示唆する重要な情報となるかもしれない。MELFパターン自体の更なる分子的評価と臨床的意義に関しての更なる検討が必要である。今後の課題:
MELFパターンと非MELFパターンの遺伝子的背景の比較として、パラフィン包埋スライドから組織を切り出し、両群のmicroRNA発現に注目し、microRNAを抽出し、その発現パターンの意味合いを継続検討する予定である。
- CRISPR/Cas9を用いたゲノム編集による先天性第V因子欠乏症患者由来iPS細胞の遺伝子修復
-
主研究者:中村剛之、小澤秀俊、大屋周期、山崎嘉孝、森重 聡、
山口真紀、毛利文彦、大崎浩一、長藤宏司先天性第V因子欠乏症は単一遺伝子疾患で、遺伝子治療の有効性が期待される。ゲノム編集技術の治療応用の可能性を検討する目的で、我々は第V因子欠乏症患者からiPS細胞を樹立し、CRISPR/Cas9を用い、第V因子遺伝子変異を修復した。患者の末梢血単核球細胞に山中因子を導入することでリプログラミングさせ、樹立したiPS細胞にCas9、guide RNAおよび修復配列を含むベクターを電気穿孔法により共導入し、遺伝子修復iPS細胞を獲得した。患者由来iPS細胞および遺伝子修復iPS細胞をin vitroで肝細胞様細胞(iPS-HLCs)に分化誘導し、濃縮した培地上清中の第V因子抗原、活性を測定したところ、患者由来iPS-HLCsではいずれも検出感度以下であったが、遺伝子修復iPS-HLCsにおける第V因子抗原は67.0±13.1ng/ml、第V因子比活性は173.2±41.1U/mgであった。我々はCRISPR/Cas9により第V因子遺伝子変異の修復に成功し、遺伝子修復iPS-HLCsを用い第V因子活性の回復を確認した。遺伝子修復iPS細胞は病態生理の解明や遺伝子治療にとって有望である。
- Human T-cell lymphotropic virus 関連mRNAであるHBZおよびtaxの発現は、ATLLにおいて特異的な臨床病理学的特性と関連する
-
主研究者:山田恭平、三好寛明、中嶋一貴、竹内真衣、荒川文子、
柳田恵理子、大島孝一成人T細胞白血病/リンパ腫(ATLL)は、ヒトT細胞白血病ウイルス1型(HTLV-1)によって引き起こされる。HBZやtaxを含むHTLV-1関連mRNAは、ATLLの病因に深く関与している。今回我々は、88例のATLL患者の組織標本(FFPE)を用いて、HBZ mRNAとtax mRNAのin situ hybridizationを行い、ATLLの臨床病理学的特性との関連を検討した。 HBZ mRNAシグナルの中央値はATLL細胞1000個あたり795.2(range:0.4-4013.1)であり、tax mRNAシグナルの中央値はATLL細胞1000個あたり5.1(range:0.1-891.2)であった。HBZ mRNA,tax mRNA各々の中央値で2群間にわけ比較したところ、HBZ mRNAの低発現群は、皮膚浸潤が有意に多く観察された(P=.0283)。また、Tax mRNA高発現群は、PD-1陽性腫瘍浸潤リンパ球(TIL)の数が有意に増加していた(P<.0001)。さらに、本研究ではtax mRNAの発現が400以上と非常に高い症例を7例同定した。これらの症例は、HLA class Iおよびβ2-microglobulinの発現が有意に低下していた(各々P=.0385,P=.0124)。さらに、これらの症例は、その他の群に対して有意に予後不良であった(MST 22.6か月、95%CI[13.7-41.7])(P=.0499)。これらの結果は、tax mRNA高発現群では、Taxを利用した治療は慎重に施行される必要があることを示唆している。今後の詳細な研究により、ATLLにおけるHBZおよびtaxmRNA発現の臨床病理学的重要性をさらに解明することが期待される。
- セルブロックの品質管理に関する研究
-
主研究者:河原明彦、安倍秀幸、村田和也、内藤嘉紀、秋葉 純
低侵襲診断法の進歩に伴い,細胞診サンプルでのバイオマーカー検査の需要も高まっている.組織学標本と同様に,セルブロック(CB)法は細胞を詳細な組織構築を保ちながらパラフィンに包埋し,複数のスライドを作製できる.CB法は,免疫細胞化学や分子解析などのような補助的検査を提供する上で重要な役割を果たすが,私たちの知る限り,標準化されたCB作製方法はない.本年度は、CB法における核酸品質について研究成果を報告する.
1.アルギン酸ナトリウムホルマリン固定パラフィン包埋(FFPE)-セルブロック法における核酸品質と蛋白発現
アルギン酸ナトリウムを用いたFFPE-CB法が,核酸品質と蛋白発現に及ぼす影響についてホルマリン固定条件の違いを通して検討した.10%中性緩衝ホルマリンおよび10%ホルマリン(非緩衝)を用いて培養細胞を異なる時間で固定後,アルギン酸ナトリウムを用いてFFPE-CBを作製した.これらのすべてからDNA integrity number(DIN)値を測定した.免疫細胞化学に関しては,染色性や発現率について評価した.ホルマリン固定された培養細胞は,時間依存的にDNA品質が低下を示し,10%中性緩衝ホルマリンで3時間および6時間固定された培養細胞は,24時間以上固定された培養細胞に比べ,DNAは高品質であった.サイトケラチン抗体において,10%中性緩衝および非緩衝ホルマリンで3時間および6時間固定された培養細胞は良好な染色性を認め,24時間以上固定された培養細胞のKi-67核発現割合は低発現を認めた.アルギン酸ナトリウムFFPE-CBにおいて10%中性緩衝ホルマリンで3~6時間固定された細胞検体は,比較的高品質なDNAと安定した蛋白発現を得ることができる.
2.液状化検体細胞診を用いたセルブロック法の核酸品質の解析と保管への影響
液状化検体細胞診(LBC)を用いたCB法における核酸品質を解析すると共にLBC-CBの保管における核酸品質の影響についても調査した.2020年1月から3月までの期間で,体腔液細胞診で肺癌および卵巣癌と悪性診断された19例を対象にLBC-CBの核酸品質を解析した.また,2016年から2019年の期間でLBC-CB保管における核酸品質の影響について調査した.LBC検体から作製したCB標本の細胞形態は良好であり,LBC-CB切片表面の面積はDNA量に関連性を認めた(r=0.808).また,対象期間の検体において,DIN値を解析した症例は16例(84.2%)みられ,DNAの品質は比較的よく保たれていた.これらの症例において検体受取後からLBC-CB作製までの検体保存日数とDIN値に明らかな関連性はみられなかったが(r=-0.176),LBC-CBは長期保管によりDNAの品質低下を及ぼすことが明らかとなった(P<0.001).LBC-CBの核酸品質は良好であるため,充分なDNA量の確保によりさまざまな遺伝子検査への応用が期待できると考える.
- 非小細胞肺癌に対する免疫チェックポイント療法のバイオマーカー探索研究
-
主研究者:松尾規和、東 公一、星野友昭
免疫チェックポイント阻害剤をはじめとしたがん免疫療法は日常臨床において欠かせない治療となっている。現在、腫瘍組織でのPD-L1発現やマイクロサテライト不安定性などが抗PD-1/PD-L1抗体のコンパニオン診断として採用されているが、十分とは言い難い。
近年免疫チェックポイント阻害剤の登場により非小細胞肺癌の薬物治療戦略は大幅に変化している。PD-1/PD-L1経路を阻害する免疫チェックポイント阻害薬はがん免疫を再活性化させることで抗腫瘍効果を示し、非小細胞肺癌患者の予後向上に寄与している。2019年度からは肺癌に対する抗PD-1/PD-L1抗体と化学療法の併用が標準治療となり、より多くの症例で初回治療から抗PD-1/PD-L1抗体を使用するようになった。しかしいまだ長期奏功を得る事ができない例が存在する事も事実である。そのため、治療効果を予測・モニタリングするバイオマーカーの開発が期待されている。
PD-1阻害剤は免疫システムを標的とすることから、免疫動態を反映したバイオマーカーの開発が必要である。一例として腫瘍組織におけるPD-L1発現は現時点でのPD-1/PD-L1阻害剤のコンパニオン診断となっている。しかし、同一組織において発現が不均一である、経時的に発現が変化しうるなど、問題点も多い。さらに採取のためには気管支鏡などを用いた侵襲性の高い手技が必要であり、かつ病変の部位やサイズによっては採取困難な例も存在するなど検体確保にも問題が生じる例がある。末梢血は低侵襲かつ繰り返し採取することが可能であり、免疫チェックポイント阻害薬使用前後の免疫動態を把握できる可能性を秘めている。そのため、我々は非小細胞肺癌患者に対して免疫チェックポイント阻害剤治療前後の末梢血を解析し、バイオマーカー候補となる血球因子や可溶性因子の探索を行っている。
- T1 浸潤性肺腺癌: Thin-section CT solid scoreと組織学的ペリオスチン発現が腫瘍再発を予測する
-
主研究者:岩本良二、田上秀一、長田周治、小金丸雅道、
角 明子、近末智雅、高森信三、大島孝一、藤本公則背景と目的)腺癌は、非小細胞肺癌(NSCLC)の最も一般的な組織型であり、特に早期の肺腺癌において、外科的切除後の予後を予測するためのさまざまなバイオマーカーが提案されている。ペリオスチン[POSTN、PN、または骨芽細胞特異的因子(OSF 2)とも呼ばれる]は、細胞外マトリックスタンパク質であり、その発現はNSCLC 患者の腫瘍浸潤性に関連している。本研究では、外科的切除前のThin-section CT所見、およびペリオスチン発現を含む組織学的特徴を評価し、T1浸潤性肺腺癌の切除後の転帰を予測する価値があるか検討した。
患者と方法)2000年1月から2009年12月の間に外科的切除を受けた合計73人の患者が登録された。2人の胸部放射線科医が独立して、Thin-section CT所見、すなはちi)輪郭、ii)固形成分を有するすりガラス結節(part-solid GGN)または固形結節(solid nodule)、iii)固形成分のパーセンテージ(CT solid score)、iv)空気気管支像および/または気泡透過性の存在、v)関与する血管の数、結節と内臓胸膜の間の線状構造のvi)形状、vii)数の合計7つのパラメーターを評価した。ペリオスチンの発現は、染色の強度と程度に基づいて評価した。その後、Cox比例ハザードモデルを使用して、単変量および多変量解析を行った。
結果)7つのThin-section CTパラメータの分類に関して、2人の観察者間でほぼ完全な一致が見られた(κ=0.64~0.85)。単変量解析では、CT solid score>80%、病理学的リンパ管浸潤、腫瘍(T)およびリンパ節(N)因子、および高いペリオスチン発現が再発と有意に関連していた(すべてP<0.05)。多変量解析により、CT solid score>80%および高いペリオスチン発現が再発の危険因子であることが示された(それぞれP=0.002および0.011)。3つのグループ(両方とも陰性、CT solid score>80%または高いペリオスチン発現、または両方が陽性)間の累積再発率は有意に異なっていた(ログランク検定、P<0.001)。
結論)術前のThin-section CTのCT solid scoreと切除された腫瘍標本の組織学的ペリオスチン発現は、T1浸潤性肺腺癌の術後再発の予測に役立つ可能性がある。
- がんパネルFoundation Oneを用いた中枢神経原発悪性脳腫瘍における遺伝学的解析
-
主研究者:中村英夫、小牧 哲、音琴哲也、森岡基浩
中枢神経原発悪性脳腫瘍において最も代表的なものに悪性神経膠腫があり、頻度も高い。近年、悪性神経膠腫を含めた悪性脳腫瘍の診断は、分子遺伝学的解析が導入されたことにより、従来の病理学的診断に比べてより客観的な診断となっている。しかし、いくつかの代表的な分子の遺伝子異常などを基に最終診断としているが、それでもなかなか分類が困難なものも存在する。特に小児の悪性脳腫瘍においては、稀な腫瘍が多く分子遺伝学的解析をおこなっても分類することができないものがあり、臨床的な治療方針が立てにくく、また臨床的経過を予想することが難しい。久留米大学では、がんパネル検査なども使用可能なことから希少疾患である悪性脳腫瘍においても積極的により多くの遺伝子異常を検索することにしているが、その結果と臨床経過や治療反応性を蓄積することによって新しい知見を見出すことを目標とする。更に悪性神経膠腫においてはある程度の症例数があるために、過去のサンプルを再度解析可能な分子遺伝学的診断を行い、臨床的予後との相関の見直しができないかと考えている。
- がんの悪性進展と治療耐性を担う機序と新規バイオマーカー創出の研究
-
主研究者:河原明彦、東 公一、西尾 真、主藤朝也、赤木由人、
秋葉 純、服部 聡、鹿毛政義、小野眞弓、桑野信彦1.はじめに
個々のがんの増殖や生存を担う標的分子やメカニズムを明らかにして個々のがん患者へ適切な治療を実践する“Precision Medicine”の必要性が提示されて、10年近い年月が流れている。科学的根拠に基づいたがん治療には個々のがんの特性を把握することが要求される時代を迎えている。
我々は、我々の独自性の高いがん関連バイオマーカーについて、がん細胞とがん微小環境を構成する非がん細胞におけるがん悪性化に特異的な機能を明らかにしながらがんの個性を特徴づける研究を進展させている。その結果、がんの進展に関与する分子的背景や関与する遺伝子や遺伝子群を見出してがん治療へ貢献したいと考えている。本年度は、N-Myc Downstream Regulated Gene 1(NDRG1)のがん細胞と血管内皮細胞での役割についての研究成果とY-ボックス結合タンパク質-1(YB-1)によるホルモン受容体ERαの発現制御についての研究成果を報告する。2. NDRG1は脳腫瘍でがん抑制的に働く
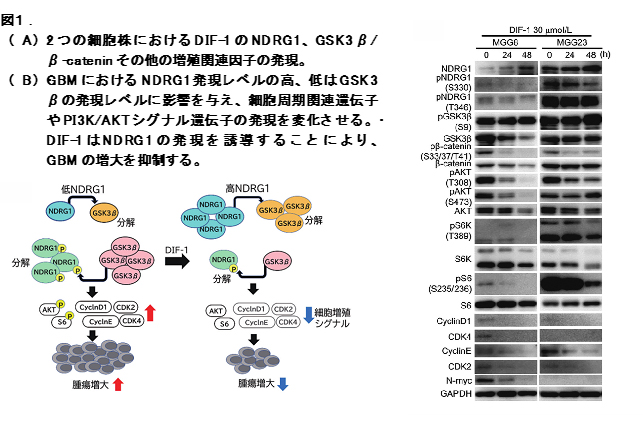
我々は、約20年前にNDRG1をヒト脳腫瘍に観察される単球/マクロファージに発現し、マクロファージの浸潤が血管新生と相関していることを報告した。今回、脳腫瘍(Glioblastoma)(GBM)におけるNDRG1発現がGSK3β/β-カテニン‐シグナルや増殖に影響を与えること、さらにDifferentiation Inducing Factor-1(DIF-1)がNDRG1を介して脳腫瘍増殖を制御することを見出した。
2つの脳腫瘍細胞株(MGG8とMGG23)においてDIF-1がNDRG1の発現を上昇させるとともにGSK3β/β-カテニン-シグナルを抑制している(図1A)。さらに同様な結果は脳内同所移植のGBMに対するDIF-1のin vivo治療実験系でも、腫瘍増大の抑制とともに観察された。現在、考えているNDRG1を対象とした治療モデルを図1Bに示す。すなわち、GBMおいてNDRG1はがん抑制因子として働き、DIF-1はNDRG1の発現を亢進させることによって抗腫瘍効果を示すことが示唆された。3.NDRG1はがん微小環境において血管新生へ影響を与える
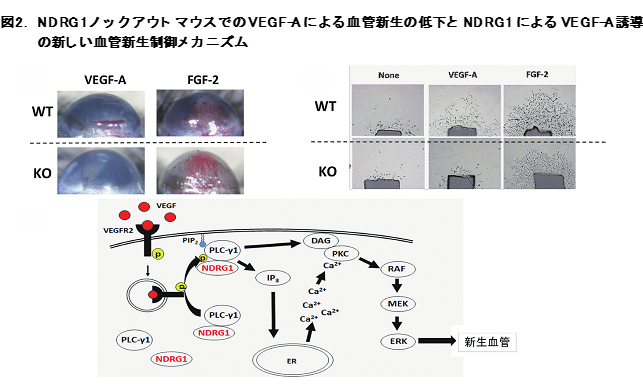
NDRG1発現はがんの種類によってがん促進的に働いたり、がん抑制的に働いたりすることがこれまで多くの研究報告により発表されている。さらに我々は、マクロファージでのNDRG1発現が骨破壊細胞への分化へ関連し、骨形成に重要な役割を果たしていることを報告した。今回、NDRG1ノックアウト(KO)マウスを対象にして、血管内皮細胞におけるNDRG1の発現が血管新生へ影響を与えるか否かを検討した。
NDRG1-KOマウスと野性型(WT)マウスにおける眼角膜血管新生誘導実験を図2Aに示す。FGF-2によって両マウスで血管新生が誘導されるがVEGFではKOマウスが著明に低下していることが観察される。さらに、マウスからの大血管を用いた血管新生アッセイ系においてFGF-2ではWTとKOマウス両方で血管新生が誘導されるが、VEGFではKOマウスで著明に低下している(図2B)。さらに、VEGFによる血管新生が低下しているメカニズムを解析した結果、血管内皮においてVEGFとVEGF受容体(VEGFR)が結合し、細胞内へ取り込まれた後、PLCγ1/ERKシグナルの活性化による血管新生にNDRG1が重要な役割を果たしていることを報告した(図2C)。このマウスでの現象はヒト血管内皮を用いたin vitro系でも同様に観察されているが、ヒトの生体内でのNDRG1の関与についてはこれからの研究課題である。4. 乳がんにおいてYB-1は、ホルモン受容体ERα発現を抑制し、抗ホルモン治療耐性に関与している
乳がんのERα陽性患者に対する抗ホルモン治療はタモキシフェン、フルベストラント、アロマターゼ阻害剤などが使用されている。ERαの発現低下や突然変異の出現などは抗ホルモン治療耐性に関与している。2008年に乳がん患者と乳がん細胞において、ERαの発現がYB-1の発現と逆相関を示すことを発表して以来、我々はそのメカニズムと臨床的意義について仕事を継続させている。
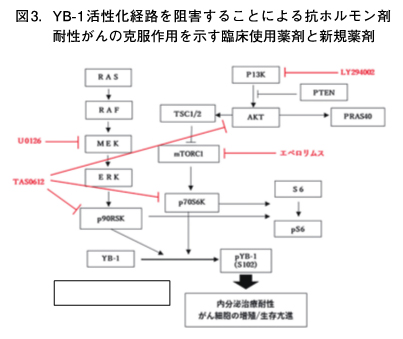
今回、我々はYB-1の発現を上昇させると、乳がん細胞のERαの発現が低下し、タモキシフェンやフルベストラント耐性を示すことを観察した。さらに、YB-1を活性化する経路として、PI3K/AKT/mTOR経路ならびにRAF/MEK/ERK経路が作動していることを観察した(図3)。さらに、これらのシグナルの活性化阻害剤で治療することによってタモキシフェン耐性をin vitro及びin vivo実験系で克服することを見出した。これらの薬剤との併用による臨床試験についての可能性を現在検討中である。5. まとめと考察
NDRG1については、その機能の多様性に驚かされる。血管新生に関連してヒトの血管新生に関与しているか否かはこれからの課題である。さらにGBMについてはNDRG1の抗腫瘍効果について解析を進めたが、NDRG1と密接に関連するシグナルを明らかにして、がん治療の創出に貢献できるか否かを検討する必要がある。他方、乳癌におけるYB-1とその活性化を標的とする治療戦略が耐性克服へ有用か否かもこれからの課題である。卵巣癌におけるYB-1の役割についての基礎及び臨床研究を始めているが、2つのがん種においてがん治療の標的としての有用性について今後検討していきたい。